薬物活性学
細胞内タンパク質分解を標的とした創薬研究
~タンパク質分解系の活性化で神経細胞を元気に~
細胞内タンパク質分解の重要性
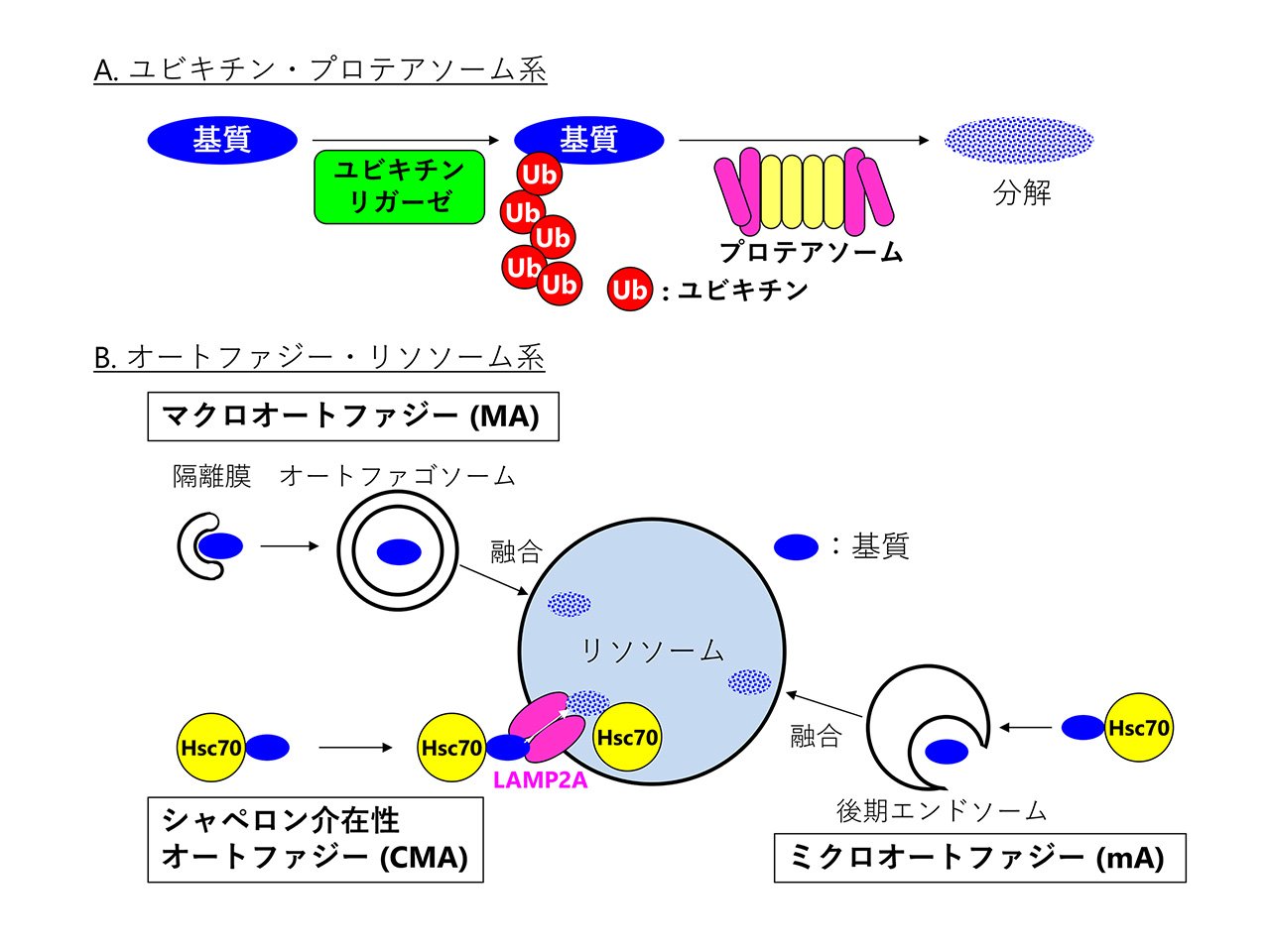
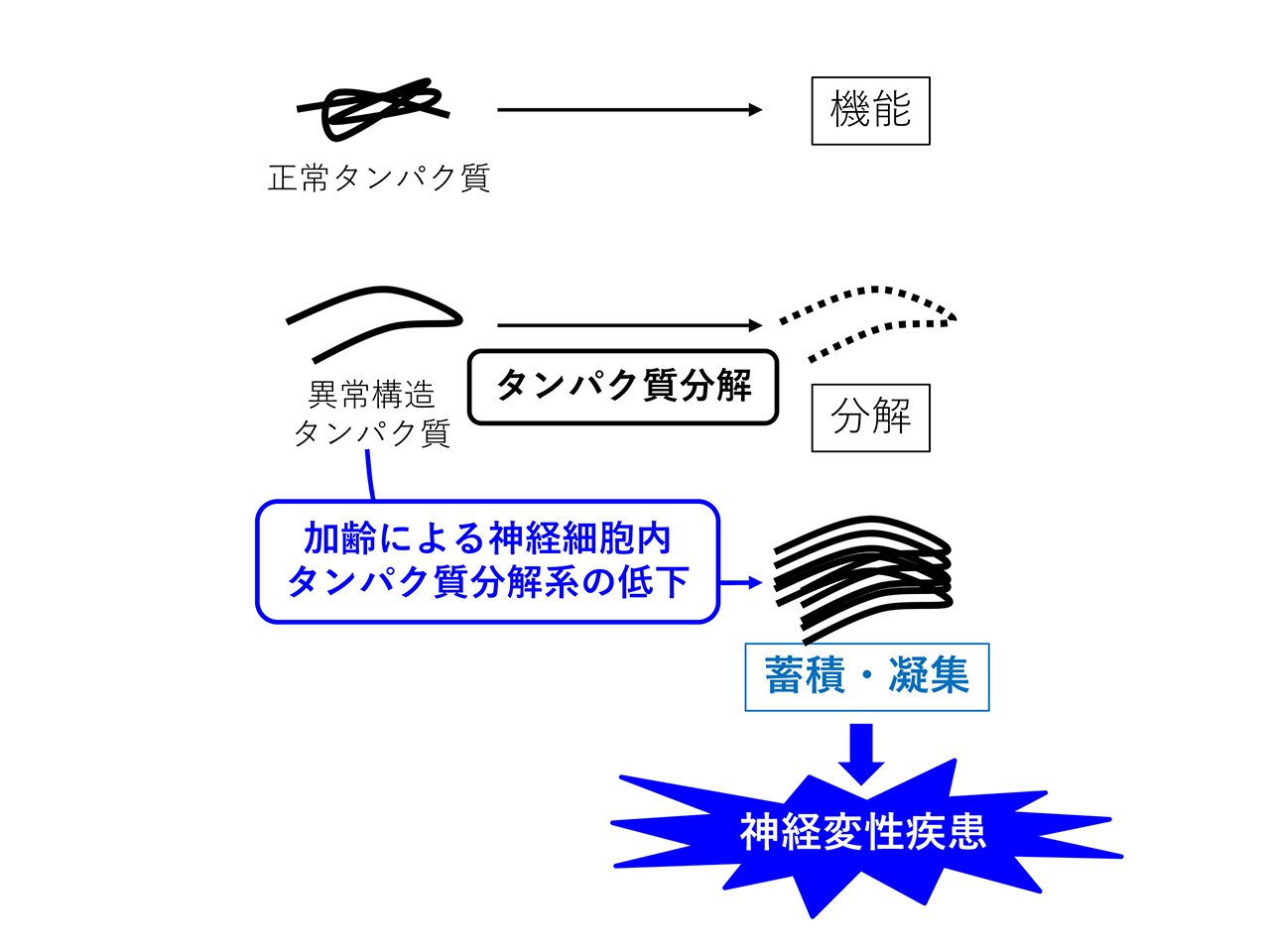
遺伝情報が書き込まれたDNAからRNAが転写され、RNAから機能性分子であるタンパク質が翻訳されます。この一連の流れをセントラルドグマといい、19世紀後半から20世紀半ばにかけて、セントラルドグマに関する研究は盛んに行われてきました。一方で、必要のなくなったタンパク質は細胞内タンパク質分解系により処理されていきます。この機能は細胞にとって重要ではないと考えられ、以前はあまり注目されていませんでした。しかし、1953年にタンパク質分解は細胞のエネルギー源であるATPを消費して行われることが判明しました。これはエネルギーを使ってまでタンパク質を分解する必要がある、ということを意味しており、これを機に細胞内タンパク質分解に注目が集まり、研究が進んでいきました。 細胞内タンパク質分解はユビキチン・プロテアソーム系とオートファジー・リソソーム系という2種類の経路が存在します(図1)。両者の共通の機能として、細胞内タンパク質恒常性の維持が挙げられます。細胞内で産生されたタンパク質は一定の割合で異常構造を取ります。細胞内タンパク質分解系は、これら異常タンパク質を積極的に分解することで、細胞内タンパク質の恒常性維持に貢献しています(図2)。その重要性が認められ、ユビキチン・プロテアソーム系に関する研究は2004年のノーベル化学賞受賞、オートファジー・プロテアソーム系に関する研究は2016年の大隅良典教授のノーベル医学・生理学賞受賞に繋がりました。
神経細胞における細胞内タンパク質分解
異常タンパク質が細胞内に蓄積しても細胞は分裂することで2つの細胞に分配して減らすことができます。しかし、神経細胞は細胞分裂能を持たない上に他の細胞に比べタンパク質合成が盛んで、異常タンパク質が産生される頻度も高くなります。よって、神経細胞は他の細胞に比べて、タンパク質恒常性の維持に細胞内タンパク質分解が特に重要です。加齢とともにタンパク質分解系の機能が低下していきますが、神経細胞はその影響を受けやすく、異常なタンパク質が蓄積・凝集することで神経細胞死が引き起こされます。これがアルツハイマー病などの神経変性疾患発症に関与すると考えられています(図2)。よって、細胞内タンパク質分解の機能を高める薬は、神経細胞死を抑制することが期待され、神経変性疾患の治療に有効ではないかと考えられています。
オートファジーを標的とした創薬研究
オートファジー・リソソーム系には図1に示す3つの経路が存在しています。大隅教授のノーベル賞受賞はこの中のマクロオートファジー(MA)に関する研究であり、一般的にオートファジーと言えばMAのことを指します。これまでに幅広い研究が展開され、MAは様々な生理機能に関わることが解明されています。MAの活性を変える薬は様々な生理機能に影響し、多様な副作用が起こると想定されるため、MAを標的とした治療薬は実用化に至っていません。 熊薬の薬物活性学分野ではオートファジー・リソソーム系の中でも研究のあまり進んでいないシャペロン介在性オートファジー(CMA)に注目した創薬研究を行っています。CMAはMAとは異なり、哺乳細胞にしか存在しないため、MAに比べて生理機能への関与は少なく、創薬標的としてはこちらの方が相応しいと考えられます。最近、小脳神経選択的にCMA活性を低下させたマウスにおいて、神経細胞死と小脳性の運動障害が起こることを解明しました。これは、小脳神経の変性が原因で発症する脊髄小脳変性症と類似した症状であり、脊髄小脳変性症の発症にCMA活性の低下が関与する可能性を示しています。それ以外にもパーキンソン病などの他の神経変性疾患においてもCMA活性低下が起こることが報告されています。従って、CMA活性化薬は様々な神経変性疾患治療に有効と考えられます。しかし、CMAを選択的に活性化する薬は存在しません。当分野では独自に確立したCMA活性評価法を用いてCMA活性化薬の探索を行い、神経変疾患治療薬への臨床応用を目指しています。
脳出血の新たな治療法を求めて〜脳の炎症を薬で制御する〜
脳出血とは
脳に酸素や栄養を補給する脳血管系のはたらきは、脳機能を正常に保つためにとても重要です。脳血管のはたらきが破たんすることで生じる病気を脳卒中と言い、これには主に脳血管がつまるもの(脳梗塞など)と脳血管が破れるもの(脳出血など)があります。脳出血の場合、破れた血管から漏れ出た血液は、血液の塊(血腫)を作って脳の組織に物理的なダメージを与えますが、血液に含まれるいくつかの成分が脳の細胞に直接作用し、脳組織の炎症反応を引き起こすことなどによってもダメージが拡大します。
脳出血は致死率が高く、また生存した場合も半身まひなどの重い後遺症をもたらす病気です。脳出血による脳のダメージを防ぐ薬物療法は確立されておらず、新たな脳保護薬の登場が期待されています。
脳出血の動物モデル
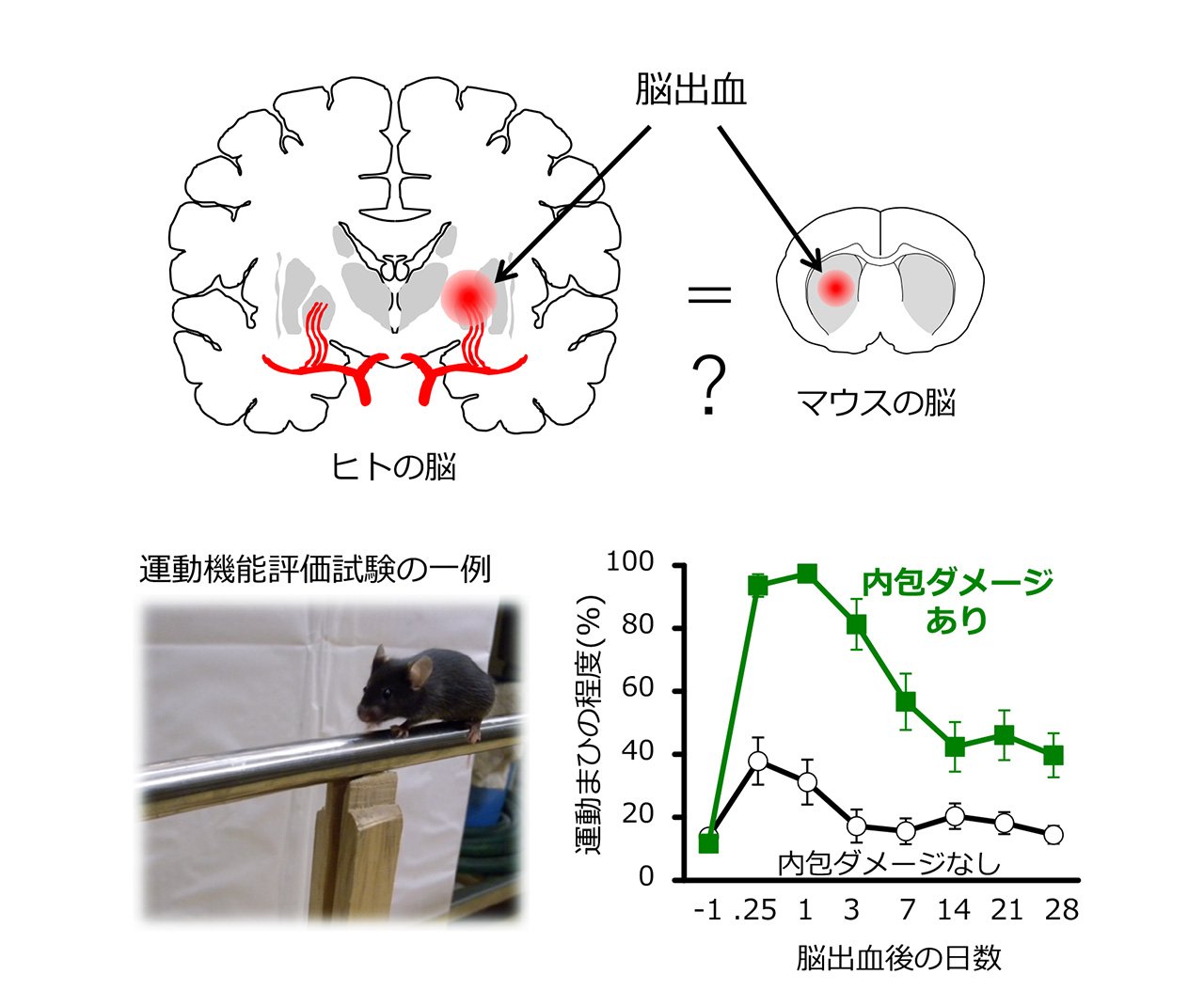
新薬を開発する過程では、病気の動物モデルを用いた薬物効果の検討が必要になります。脳出血の動物モデルを作成する場合、マウスなどの実験動物の脳にコラゲナーゼという酵素を注入し、血管壁を溶かすことで出血を誘発する、という方法があります。マウスの脳はヒトの脳とかなり異なる形をしていますが、私たちはコラゲナーゼの注入場所と、注入の結果できた血腫の大きさや位置、そしてマウスの致死率や運動まひの程度などの関係性について詳しく調べ、実験条件を適切に設定して作成したマウス脳出血モデルがヒトの脳出血の状態をかなり忠実に反映できることを明らかにしました。特に、脳の中の「内包」と呼ばれる場所が出血によってダメージを受けると、重い運動まひが生じます(図1)。私たちはこのような動物モデルを用いて、新たな脳出血治療薬の開発に貢献するための研究を進めています。
脳の炎症を鎮める
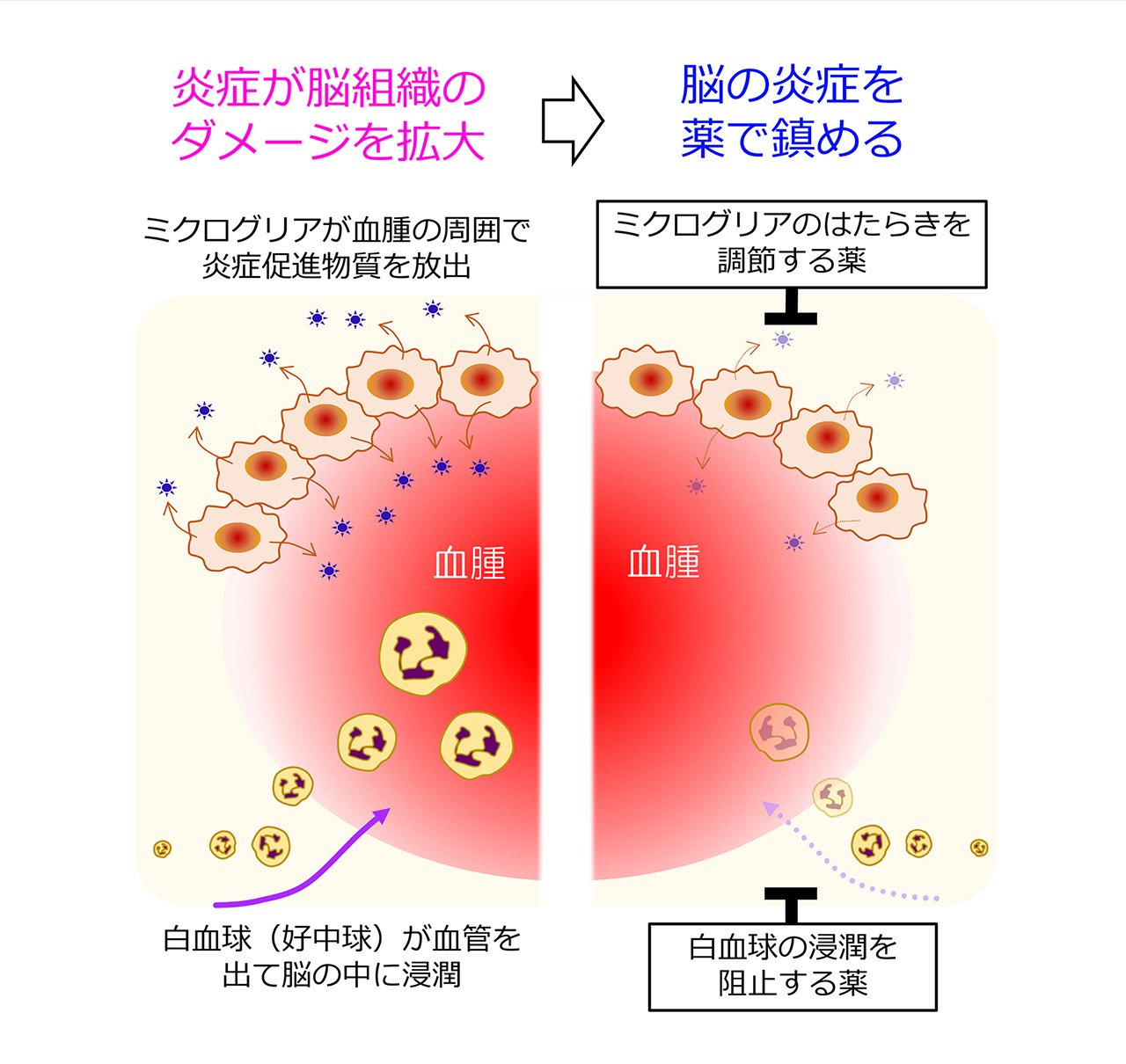
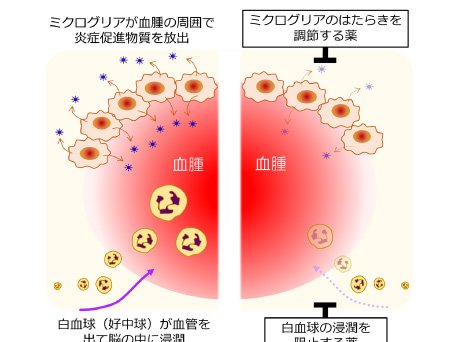
さて、炎症反応が脳出血による脳のダメージの拡大に関わるのであれば、炎症反応を抑えてしまえば良いということになりますが、それにはいくつかの方法が考えられます。一つの方法は、ミクログリアという細胞のはたらきを調節することです。ミクログリアは脳の中で多彩な役割を担っている細胞で、過剰な炎症を引き起こすこともあれば、炎症を収束させて組織の修復に寄与する側面もあります。私たちは、ミクログリアからの炎症促進物質の放出を減少させることのできる薬物が脳出血による脳のダメージやマウスの運動まひを軽減することを見つけています(図2の上半分)。
また別の方法として、白血球の動きを阻止するというものがあります。脳出血が起きると、血液に含まれている白血球も当然ある程度脳の中に入り込んできますが、血腫ができあがって出血が止まった後になっても白血球(特にそのなかでも好中球という細胞)はじわじわと脳の中へ滲みこんできて(浸潤という)、脳の炎症反応に関わることが分かってきています。私たちは、そのように遅れてやって来る白血球の浸潤を食い止めることのできる薬物がマウス脳出血モデルの症状を改善することも明らかにしました(図2の下半分)。こういった研究の積み重ねによって、新たな治療薬の開発への糸口が少しずつ見え始めています。