生命分析化学
新たな抗体分子をつくり医療につなげよう
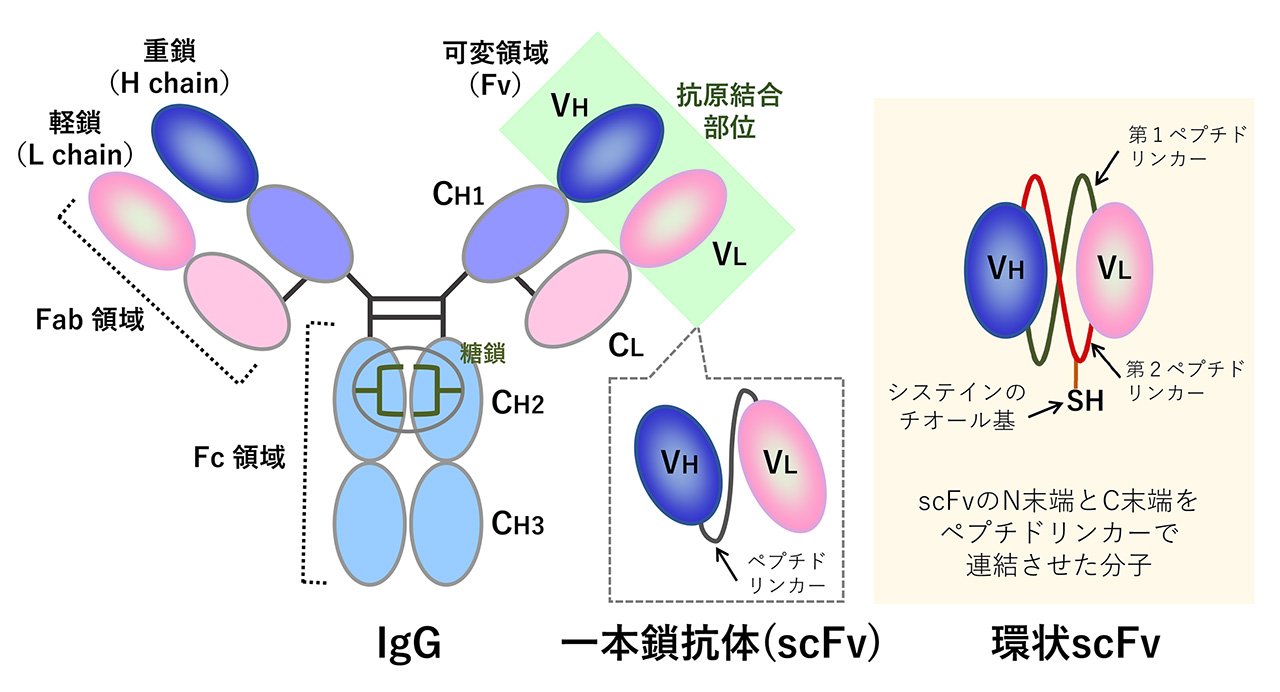
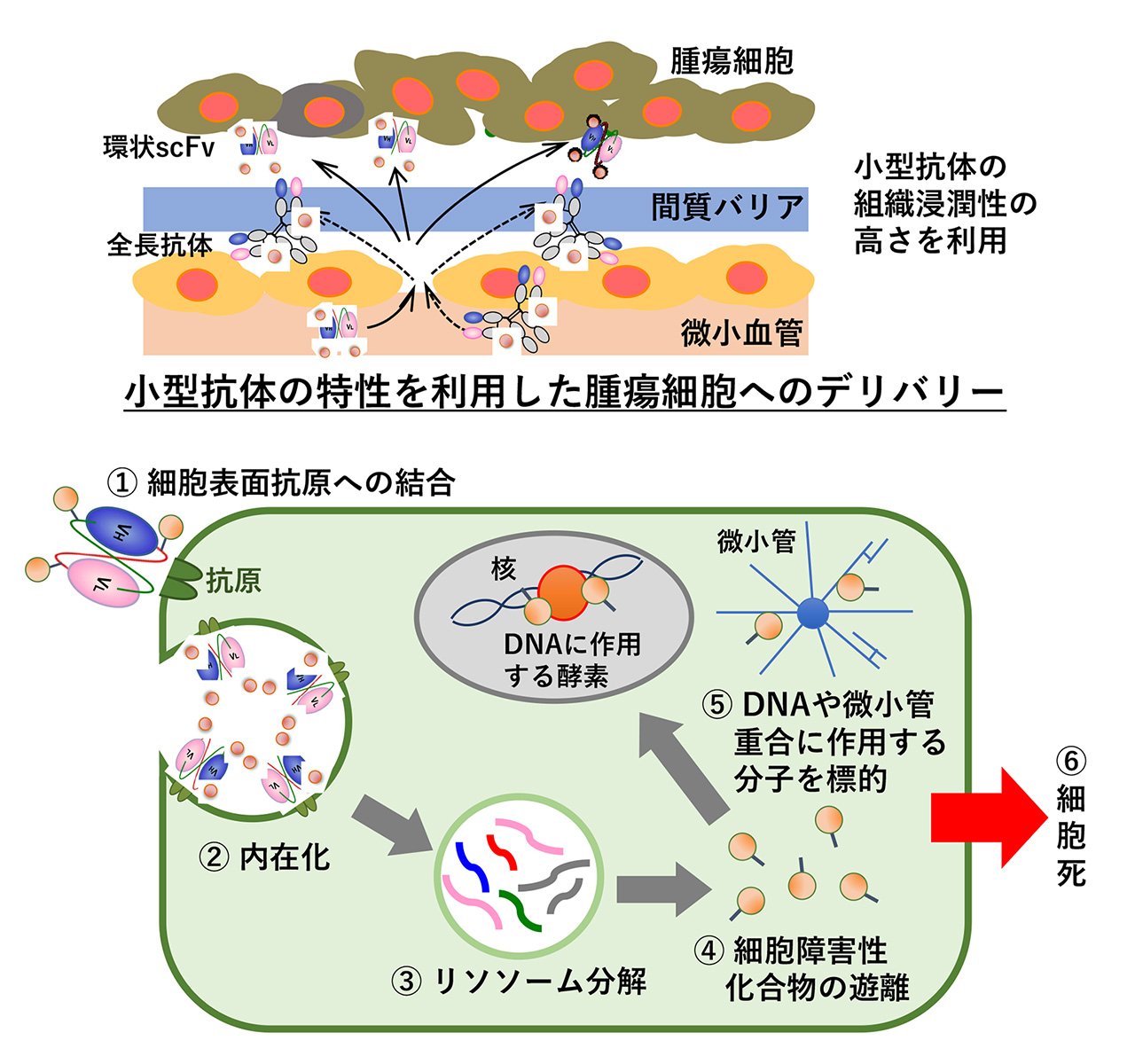
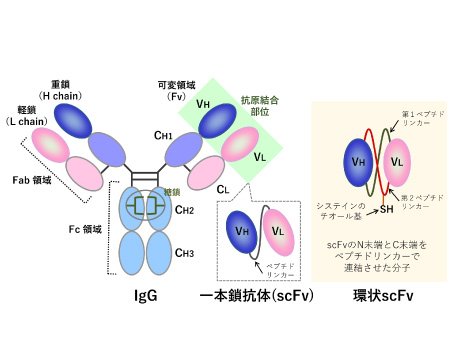
糖タンパク質の一種である抗体(免疫グロブリン)は、抗原(抗体の標的分子)に対して特異的に結合する性質を持ち、脊椎動物の感染防御システムにおいて重要な役割を担っています。また、医薬品への活用や様々な分野において研究ツールとして利用されています。抗体分子には抗原を認識する可変領域(Fv領域)といわれる場所があり、Fv領域は重鎖(H鎖)由来のVH部分と軽鎖(L鎖)由来のVL部分から構成されています(図1)。このVHとVLをペプチドリンカー(十数個のアミノ酸からなるペプチド)でつないだ分子が一本鎖抗体(scFv)です。scFvの大きな特徴は、標的分子(抗原)をとらえることができるターゲティング能をもつことです。抗原が病気に関与する物質である場合、scFvは、その病気にかかっているかどうかの診断(病態解析)やその分子のはたらきを抑える薬としての利用につながります。scFvは、IgG抗体よりも分子量が小さいため、細胞内で速やかに動き、その効力を発揮します。また、低分子量という性質は、バクテリアでの生産が可能で、安価に製造できるという利点があります。一方で、VHとVLの間の相互作用が弱いため、しばしば不安定化や活性の低下を招いてしまいます。この問題は解決することが難しく、scFvの医薬品への応用は停滞していました。私たちは、scFvの末端同士をペプチド結合で連結した環状一本鎖抗体(環状scFv)を創製しました。環状scFvは不安定性が通常のscFvに比べて大幅に低減されていることを見出しました。私たちの研究室では、この環状scFvを医薬品に応用することを目指した研究を進めています(図2)。
新しい抗がん剤を求めて
~敵(薬の標的)を知る~
チロシンキナーゼとは
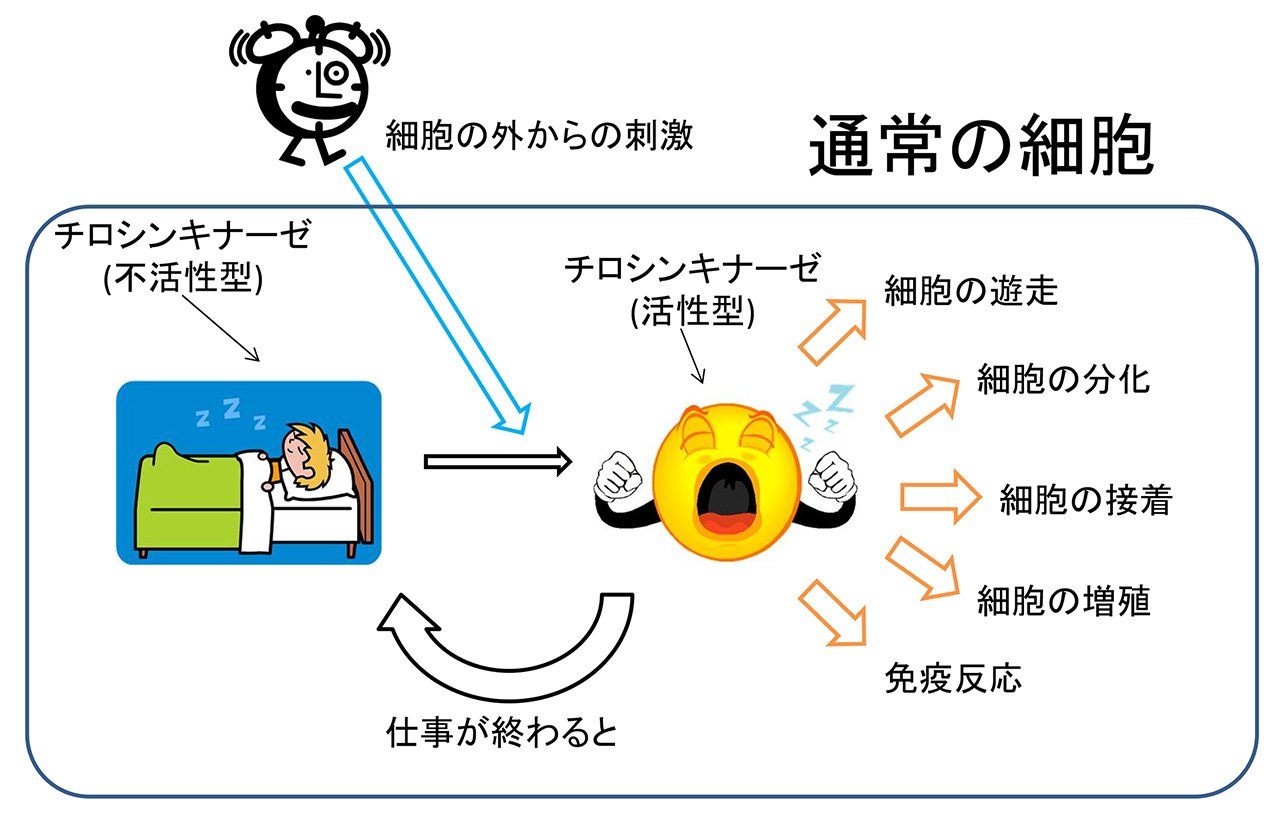
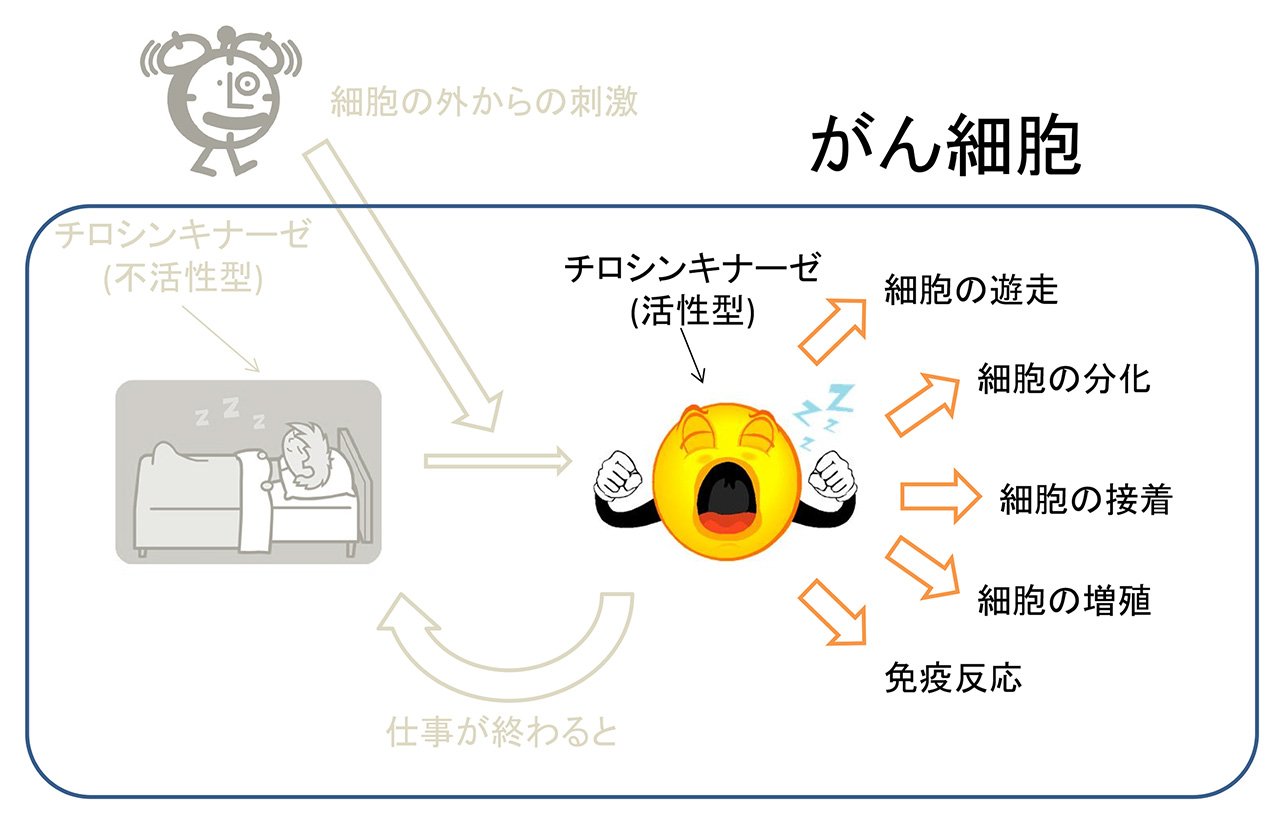
チロシンキナーゼは、タンパク質を構成するアミノ酸の1種であるチロシンのリン酸化を触媒する酵素です。ヒトを含めた多細胞生物のみに存在し、細胞の分化,増殖、接着、免疫反応など様々な生体反応の引き金となっています。チロシンキナーゼには不活性型と活性型の2つの状態があります。通常は不活性型として存在していますが、細胞の外からの刺激により不活性型から活性型へと変化し、機能が発揮されます(図3-a)。通常の細胞ではチロシンキナーゼの活性は厳密に制御されています。何らかの理由により、その制御が効かなくなって暴走を始めてしまうと、無秩序に細胞が増え続けたり、無秩序に免疫反応が起こったりすることで、がんを始めとする様々な病気になります(図3-b)。そのため、チロシンキナーゼは薬の標的として重要なタンパク質となっています。実際、チロシンキナーゼを標的とした薬が臨床現場で数多く用いられています。例えば、慢性骨髄性白血病や消化管間質腫瘍 (GIST)の治療に用いられるグリベック、タシグナ、スプリセル、非小細胞肺癌の治療に用いられるイレッサ、タルセバ、腎細胞がんの治療に用いられるスーテント、ネクサバールなどが挙げられます。しかし、それらの抗がん剤を使用していると、薬が効かなくなってくることがあります。 私たちのグループでは、それらのチロシンキナーゼ阻害薬が効かなくなるのはなぜなのか、という疑問を原子レベル、分子レベルで理解することを目指して研究を行っています。それにより、新しい抗がん剤の開発が進むことが期待されます。
アミロイドーシスの発症機構を明らかにして薬をつくる
遺伝性ATTRアミロイドーシスとは?
遺伝性ATTRアミロイドーシスは、血清タンパク質であるトランスサイレチン(TTR)の遺伝子変異により発症する疾患です。変異型TTRにより形成されたアミロイド線維が神経を中心に全身の様々な臓器に沈着することで機能障害を引き起こします。本疾患の患者は世界中に広く存在しており、特に日本は患者数が世界で3番目に多く、熊本大学には診断・研究の拠点があります。従来は、TTRの主要な産生臓器である肝臓を置換する肝臓移植が唯一の有効な治療法でした。近年では、アミロイド形成を抑制する薬剤やTTR産生を抑制する薬剤などが開発され、本症の生命予後は改善しつつあります。しかしながら、本疾患の発症に関わる分子機構については未だに多くの謎が残されています。
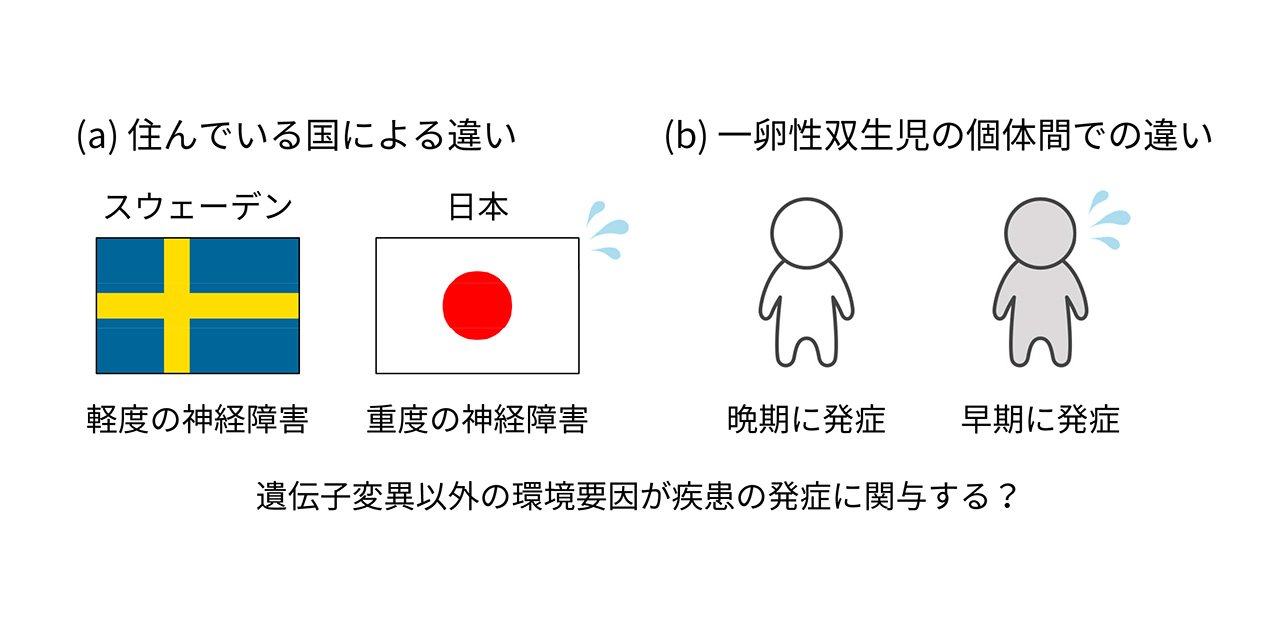
遺伝子変異だけが疾患の原因ではない?
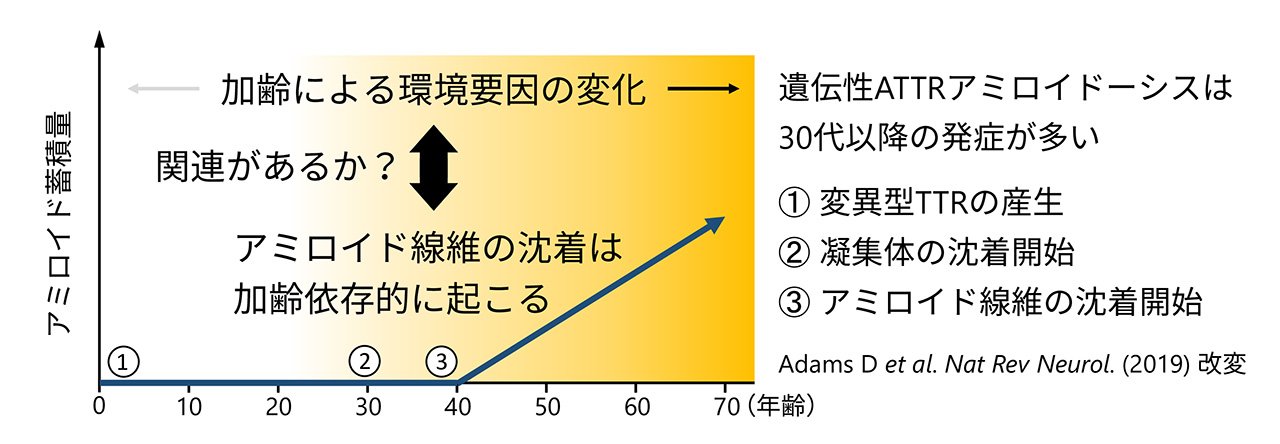
これまでに遺伝性ATTRアミロイドーシスの原因が遺伝子変異だけでは説明できないことが知られています。その例として、同じ遺伝子変異を持っていても国や地域によって疾患の重症度が異なること、同じ遺伝子変異を持っている一卵性双生児においても発症年齢が異なることが報告されています(図4)。また、変異型TTRは生後から産生され続けているにも関わらず、アミロイド線維の沈着は壮年期以降にしか起こりません(図5)。これらの知見は、本疾患の発症に遺伝的要因だけではなく、加齢に伴い変化する環境要因が関わることを示唆しています。しかしながら、加齢に伴い変化するどの環境要因がどのように発症を制御しているのかは明らかになっていません。
どうやって新しい薬を生み出すのか?
本研究分野では疾患の発症機構を明らかにした上で、発症に重要なステップを標的とする治療薬の開発を目指しています。私たちは、従来とは異なる独自の研究手法を用いて疾患の発症機構を解析したところ、TTRのアミロイド形成過程で生じる新たな中間体を世界で初めて発見しました。また、この中間体が細胞に対する毒性発現の本体となることを明らかにしており、発症の鍵となる構造体であると考えられます。今後、この中間体の形成を抑制する薬を発見できれば、今までとは異なる作用機序の薬を開発することが可能となります。さらに、加齢に伴い変化する環境要因の中から、この中間体の形成を制御する因子を同定できれば、生活習慣の改善などによる発症予防にも貢献することが期待されます。