薬剤部・臨床薬物動態学
がん個別化治療への挑戦
~臨床薬物動態学分野(熊本大学病院薬剤部)~
がん分子標的薬とは?
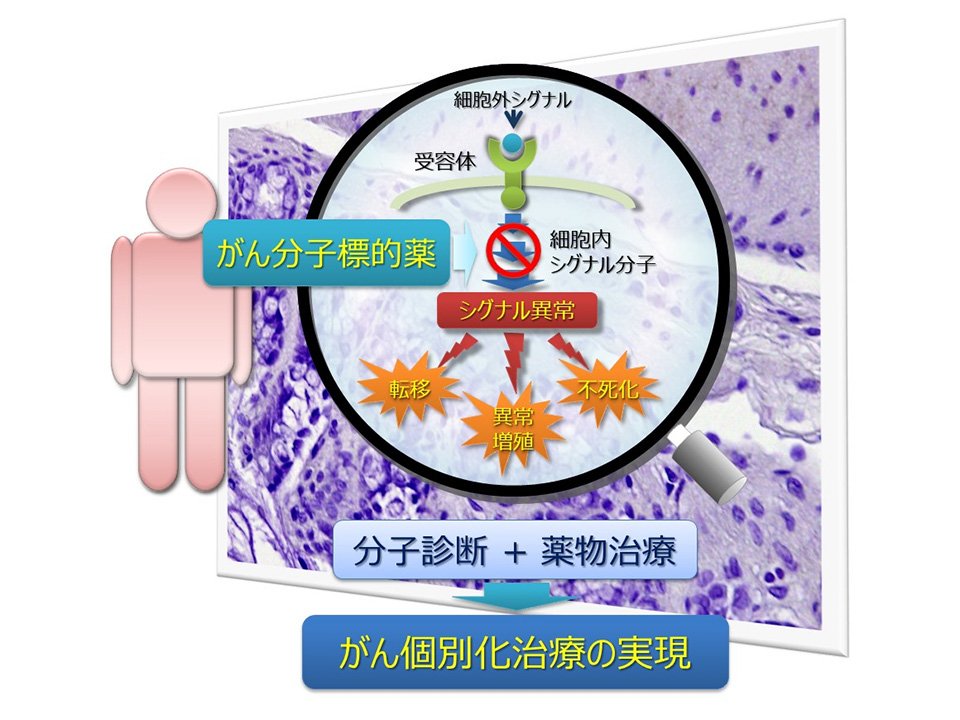
がんは,その特徴として,細胞の無制限で無秩序におこる増殖,浸潤・転移,不死化などが知られていますが,これらの現象は,細胞の増殖・分化などに関与するシグナル分子が変異等の要因によって制御不能になることで発生します.これまでの研究から,変異により細胞をがん化させる"がん遺伝子(oncogene)"や,シグナルの異常活性化を止めるブレーキの役割を果たしている"がん抑制遺伝子(tumor suppressor gene)"の機能不全が,がんのシグナル異常の要因であることが明らかとなってきました.
これらの研究成果をもとに,がんの要因となっているシグナル分子の異常を正常化することを目的に,がん特有の分子や遺伝子などを標的とした「がん分子標的薬」の開発が進められてきました.特に,2000年代以降は,治療の標的となる分子が数多く発見され,その機能を制御する「がん分子標的薬」が臨床の現場で広く使用されるようになり,がん患者の生命予後は大きく改善され,がん治療の選択肢は確実に広がりつつあります.
がんの個別化治療とは?
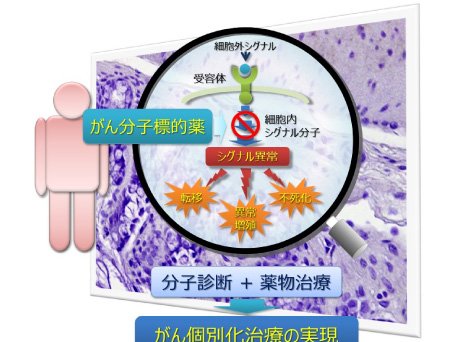
これまでの抗がん剤の主流であった「細胞障害性抗がん薬」は,がん細胞だけでなく正常な細胞にもダメージを与えることから,患者さんにとって好ましくない「副作用」が現れる可能性が大きいものでした.一方,「がん分子標的薬」は,従来の抗がん剤とは異なり,がん細胞でのみ異常をきたしている分子を標的として治療効果を発揮することから,正常な細胞へのダメージ(副作用)が少なく,がん細胞のみを効果的に攻撃することができます.さらに,標的となる分子を診断(遺伝子変異、増幅・欠失など)することで、「がん分子標的薬」が特に効果を発揮する可能性の高い患者さんを見つけることが可能となります.
代表的な例として,非小細胞肺癌の治療において,上皮成長因子受容体(EGFR)遺伝子に変異がある患者さんは、がん分子標的薬であるゲフィチニブ(EGFRチロシンキナーゼ阻害剤:EGFR-TKI、イレッサ®)の治療効果が発揮される可能性が非常に高いことが明らかとなっています.このように,がん分子標的薬は、遺伝子・分子レベルでがん細胞の特徴を診断することで治療効果を最大限に発揮することが可能となり,遺伝子変異などのがんの特徴に合わせて、一人一人に適した治療を行う「がん個別化治療」が臨床の現場で実践されています(図1).
がん個別化治療の最適化に向けて(CYLDを指標としたがんの分子診断)
「がん個別化治療」の成功の鍵を握るのは,最も治療効果の高い最適な治療の選択につながる,治療効果の予測が可能な分子マーカー(効果予測マーカー)を見つけ出すことです.このマーカーの分子診断によりがんの特徴を正確に把握することで,適切な分子標的薬を選択することが可能となります.当教室では、がん個別化治療の実現を目指し,がん治療の効果予測マーカーとしての,「がん抑制遺伝子CYLD」の可能性・有効性に着目した研究を行っています.
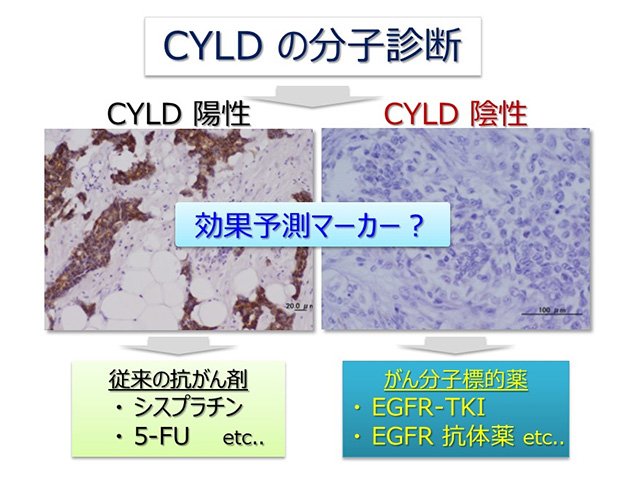
CYLD は,家族性円柱腫症の原因遺伝子として発見され,その機能異常ががんの悪性化の要因となることが報告されています.CYLD は、タンパク質のユビキチン化という修飾に関与する酵素として,多くの細胞シグナルを制御しており,特に、がん細胞におけるシグナル異常に深く関わっている分子であることがわかってきています.私たちは,がんの進行おけるCYLDの役割を明らかにする研究において,がん組織のCYLDが少ない(陰性)患者さんの方が,CYLDの多い(陽性)の患者さんよりも,生命予後が特に悪くなっていることを明らかにしました.そこで,このCYLDを指標として,がん治療の効果予測マーカーとしての可能性を検討したところ,① CYLD 陽性の患者さんは、従来の抗がん剤(シスプラチンなど)が効果を発揮する。②生命予後の悪いCYLD陰性の患者さんには,がん分子標的薬である各種EGFRチロシンキナーゼ阻害剤(EGFR-TKI)や抗 EGFR 抗体薬が特に強い効果を発揮し,がん細胞の増殖・浸潤転移を完全に防ぐことができること等の研究成果を見出しました.
以上の研究成果は、CYLD が治療の有効性を示す効果予測マーカーとなり、従来の診断により予後不良と診断されたがん患者さんに対して,CYLD の分子診断(陽性・陰性)の結果を基に,新たな治療選択を提供できる可能性を強く示しています(図2).今後も,がん患者に対して,最も治療効果が高く最適な治療の選択につながる「効果予測マーカー」の開発研究が進み,本研究が「がん個別化治療」の実現に大きく貢献することが期待されます.
腎臓のストレス防御システムの解明に基づく新たな治療薬の開発を目指して
~臨床薬物動態学分野(熊本大学病院薬剤部)~
腎臓はどのような働きをしているの?
腎臓は、お腹の後ろ(背)側に左右1個ずつあり、尿の生成や排泄を通して、体内でできた老廃物の除去(解毒)、体液やナトリウムやカリウムなどの電解質の調節、ホルモンの分泌などを担っているとても大切な臓器の一つです。体の中に投与された薬はもともと体にとって異物ですので、肝臓で代謝されるか腎臓で処理されて体の外に排泄されます。腎臓はとても複雑な構造を持っており、糸球体と呼ばれる血液をろ過するフィルター状の組織と、それに続く尿細管と呼ばれる細長いチューブ状の組織からできています。尿細管では、糸球体でろ過されたナトリウムなどの電解質やブドウ糖、アミノ酸などの必要な成分が再び吸収され、血液中へ回収されます。一方、不要となった老廃物や薬などの異物は、尿細管の特殊な働きによって血液中から尿中へ排泄されます。腎臓は、体にとって必要な成分が流れ出てしまうのを防ぎながら、同時に不要な物質を体の外に汲み出すという離れわざ的な働きを担っています。一方、このような働きを担っている代償として、薬や尿毒症物質などの老廃物が原因となって発生する酸化ストレスや細胞を傷つける物質に常に曝されているため、これらに対抗する強力な防御システムを兼ね備えていることがわかってきました。
腎臓はどうやって薬や老廃物(尿毒症物質など)を排泄しているの?
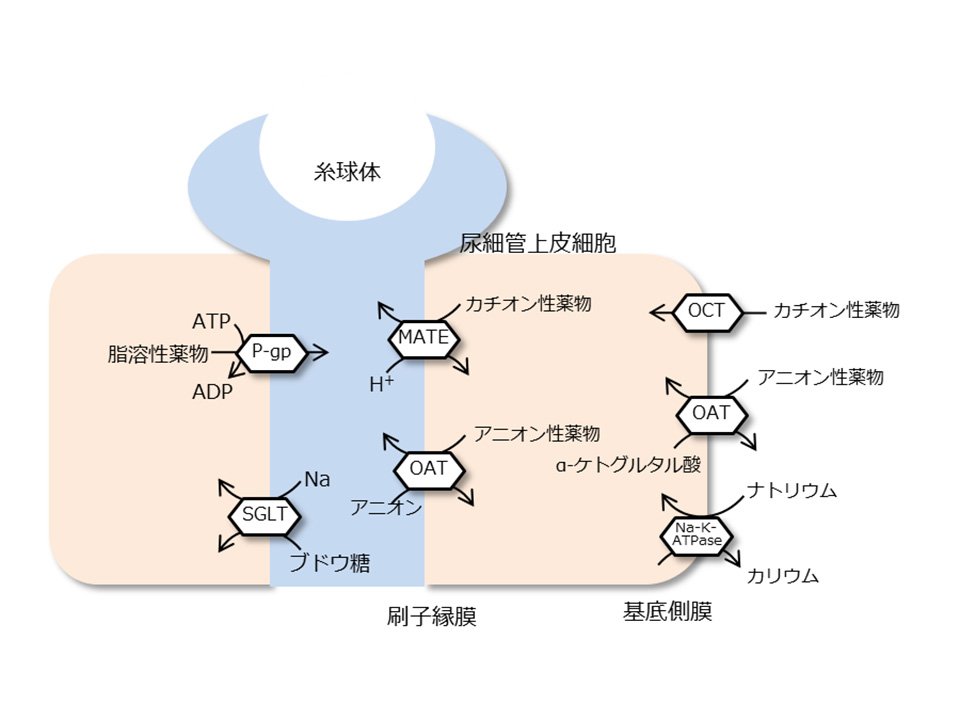
水に溶けやすく分子量が比較的小さな薬は、糸球体でろ過されてそのまま尿中へ排泄されます。一方、血液中のタンパク質に結合しやすい薬や水に溶けにくい薬などは、尿細管の細胞に存在する特殊な仕組みによって分別され、尿中へ汲み出されます。この巧妙な仕組みを営んでいるのが、薬物トランスポータと呼ばれる尿細管の細胞膜に埋まっているタンパク質です(図1)。薬物トランスポータは、様々な化学構造の物質を尿へ排泄するために備わった解毒システムの一つであり、複数のトランスポータが互いに共同して働くことで効率よく機能しています。ところが、腎臓の血流が悪くなったり、毒性のある薬物が腎臓に貯まるなど、何らかの原因によって腎臓の機能が悪くなり腎不全になってしまうと、この排泄システムがうまく働かなくなり、老廃物や毒物が体の中に溜まり尿毒症と呼ばれる疾患を引き起こすことになります。尿毒症は、その名前の通り尿毒症物質と呼ばれる様々な不要物質の体内蓄積が引き起こす病気であり、心臓、肺、血管などの病気と深く関わっていることが明らかになりつつあります。慢性腎臓病の患者さんでは、薬の排泄システムが十分に働かないため、血液中に薬が溜まってしまい、思わぬ副作用が出てしまうリスクがとても高くなるので、適切な治療計画が必要です。一度悪くなってしまった腎臓の機能を回復させる薬物は現在のところ無く、また慢性腎臓病はもとに戻らないな病気(病気が進むほど、腎臓の機能が元通りに復活することはまず無い)と考えられているため、治療法としてはあくまで腎不全に伴う症状を軽くする治療法しかありません。慢性腎臓病が進んでしまった腎不全患者さんでは、人工透析や腎臓移植が必要となりますが、人工透析は合併症も多く、患者さんの負担も大きいこと、腎臓移植では腎臓を提供する人がとても少ないのが現状です。
腎臓に備わっているストレス防御システムとは?
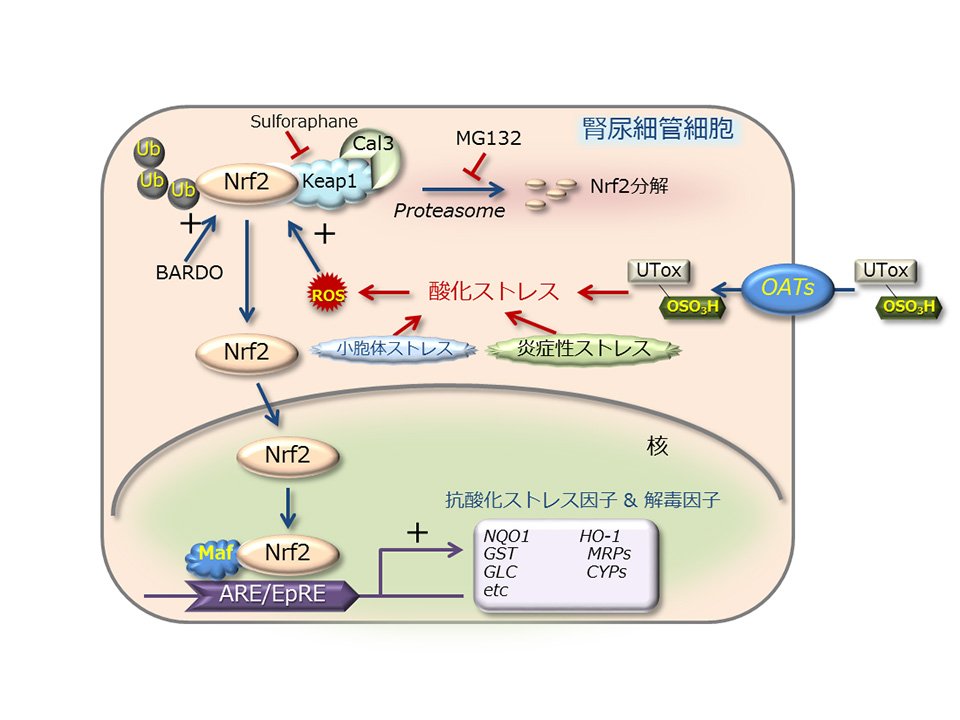
腎臓は、尿毒症物質をはじめとする様々な物質に曝されており、特に尿細管の細胞内では尿毒症物質や炎症性ストレスなどが原因で発生する酸化ストレスと昼夜を問わずバトルを繰り広げています(図2)。この防御システムの中心的役割を担っているのがNrf2と呼ばれる転写調節因子です。Nrf2は、細胞内で発生した活性酸素種(ROS)をいち早く感知して細胞質から核へ移動し、ROSや毒性を消し去る働きをもつ様々な酵素を動員するように命令を出す、いわゆる司令塔的な役割を担っています。実際にNrf2を活性化するような薬を腎障害患者さんに投与すると、腎臓の機能が回復したとの報告もあります。現在、Nrf2をターゲットにした腎臓病治療薬の開発が世界的にも注目を集めているところで、私たちもいろいろなタイプの腎臓病動物モデルを用いて、Nrf2の働きを引き出す新しいタイプの治療薬がないか調べています。
尿毒症による合併症を防ぐためにはどうすればいいの?
腎不全の原因としては、糖尿病、高血圧、免疫異常などの様々な病気との関連がわかっていますが、根本的な治療法はないのが現状です。腎不全に伴い、高血圧、神経精神症状、内分泌異常、消化器症状などたくさんの合併症が引き起こされますが、最近の研究から、一部の尿毒症物質が心臓病や血管障害などの合併症の原因になっていることがわかってきました。クレメジンと呼ばれる吸着炭でできている薬は、尿毒症物質の原料となる化合物を腸管内で除去する薬で、慢性腎臓病の進行に効果があると言われています。ただ、この薬は患者さんが飲みづらく、また尿毒症物質だけでなく他の薬も吸着してしまうため、使い方が難しいことも指摘されています。私たちは、体の中で尿毒症物質の合成を抑える薬ができれば、腎不全に伴う合併症リスクを軽減できる可能性があるのではというアイデアに基づき、製薬企業と協力して尿毒症治療薬の候補になる化合物を探す研究にも着手しています
既存薬の慢性腎臓病治療薬としての応用の可能性は?
現状、慢性腎臓病には有効な治療薬が存在せず、アンメット・メディカル・ニーズの1つに位置づけられています。前述したように腎臓は腎障害の病態発症・進展因子である酸化ストレスと昼夜を問わずバトルを繰り広げているため、Nrf2などによる酸化ストレスの制御が効果的な新規治療法と成り得ることが期待されています。一方、既存薬の中にはプレイオトロピックな効果として抗酸化作用を有する薬剤が存在し、新たな慢性腎臓病治療薬に成り得る可能性を秘めています。私たちは、既存薬であるセリンプロテアーゼ阻害薬や FXa 阻害薬がプレイオトロピックな効果として抗酸化作用を有することを明らかにしており、詳細なメカニズムの解明および新たな慢性腎臓病治療薬としての応用の可能性について更なる検討を進めています。
個人差を考慮した薬の使い方をマスターするために--個別化投与設計--
~臨床薬物動態学分野(熊本大学病院薬剤部)~
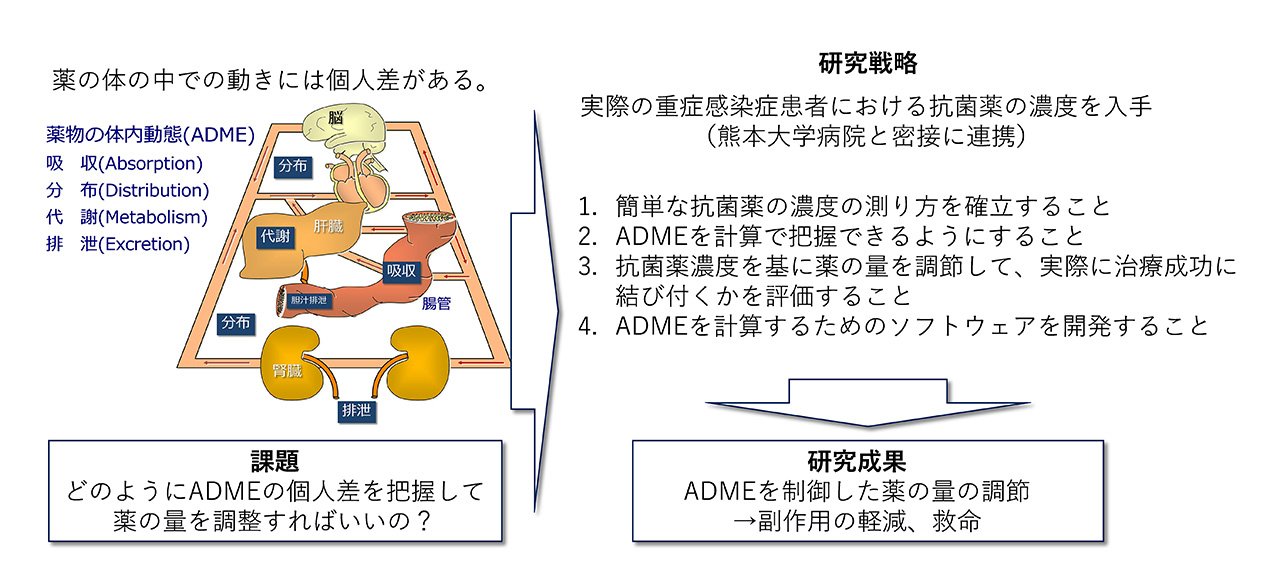
薬は体の中でどのような動きをしているの?
私たちが使う薬は、口、血管、お尻、皮膚、筋肉など、様々な部位から体の中に入ってきます。その使い方によって、薬が体の中に素早く、もしくはゆっくり入ってくるなど、その速さが変わり、この過程を「吸収(Absorption)」と呼びます。体の中に入った薬はその後、血液内、肺、筋肉、脂肪、脳など薬によって様々な組織に到達し、この過程を「分布(Distribution)」と呼びます。薬はそのままずっと体の中に残っているわけではなく、肝臓やいろいろな組織で分解され、この過程を「代謝(Metabolism)」と呼びます。代謝を受けた薬が(もちろん代謝を受けない薬も含めて)、いずれは体の外に出ていく最後の過程を「排泄(Excretion)」と呼びます。このような薬の体の中の動きにおける一連の過程を、それぞれの英語表記の頭文字をとって「ADME(アドメ)」と呼びます。薬剤師は、薬のADMEを考えながら、薬がしっかりと効果を発揮するよう、患者さんに薬の飲み方を指導しています。しかし、薬の効果は、このADMEの個人差によって変化することが知られており、たとえ同じ薬を飲んだとしてもその効果が異なることがあります。このADMEの個人差は、患者さんの病気の状態をはじめ、年齢や体重、日常の食事や健康食品、さらに、一緒に飲んでいる薬など、色々な要因によって生じていると考えられています。つまり、ADMEが変化するような個人差をうまく考慮して薬を飲まなければ、体の中の薬の動きが変わってしまい、人によっては多すぎたり、逆に少なすぎたりすることで、薬の効果が大きく変わってしまうのです。では、どのようにADMEの個人差を把握して、薬の量を調整すればいいのでしょうか?私たちの研究室は、ADMEが特に大きく変わってしまう病態として重症感染症に注目し、その治療薬である抗生物質(抗菌薬)のADMEと薬の量の決め方について研究しています。
抗菌薬はどのように重要なの?
抗菌薬は、感染症の治療に欠かせない薬で、感染症の原因となる微生物に作用してその増殖を止める作用があります。特に重症感染症患者においては、もしも抗生物質の量が少な過ぎたのであれば、数日のうちに命に大きな影響があるのです。にもかかわらず、重症感染症という病態はとても特殊で、薬のADMEが刻一刻と変わってしまうことが知られていることから、抗菌薬の量の設定がとても難しいのです。そこで抗菌薬の量を患者や病態に合わせて調節する個別化投与設計が重要ですが、様々な抗菌薬や感染症病態において、まだ確立されていないのが現状です。
どうすれば重症感染症患者の抗菌薬の量の決め方がわかるの?
私たちの研究室では、熊本大学病院と密接に連携して、実際の重症感染症患者から血液などを頂いて抗菌薬の濃度を測っています。その濃度を基に次の方法で研究を進めています。
- 簡単な抗菌薬の濃度の測り方を確立すること
- ADMEを計算で把握できるようにすること
- 抗菌薬濃度を基に薬の量を調節して、実際に治療効果に結び付くかを評価すること
- ADMEを計算するためのソフトウェアを開発すること
どのような成果が得られるの?
私たちのこれまでの研究成果の一部を紹介します。抗菌薬(バンコマイシン、セフェピム、ドリペネム)のADMEを制御し、副作用を抑え救命する方法(Oda et al. Int J Antimicrob Agents 2020、Oda et al. J Infect Chemother 2020、Oda et al. JPHCS 2019)、理想的な体内濃度に達するための方法(Oda et al. Pharm Res 2020)を明らかにし、これらのためのソフトウェアを開発しました(Oda et al. Pharm Res 2021)。現在は、多くの施設との共同研究も進めており、抗菌薬の適切な個別化投与設計によって、少しでも多くの重症感染症患者の命を救いたいと考えています。