機能分子構造解析学
生体内のタンパク質分子を原子レベルで調べる
-タンパク質のX線結晶構造解析-
タンパク質に注目!
生命現象は、生物を構成する分子のレベルでみると、基本的には生体分子間の相互作用や生体内反応で説明できます。本分野では、生体分子の中でも特にタンパク質に注目しています。タンパク質は3大栄養要素の一つとしてよく知られていますが、生体中では水に次いで多く存在し、細胞の約15%を占める生体にとって最も重要な生体高分子の一つです。生命現象の基本である生体分子間の相互作用や生体内反応でタンパク質がはたらいており、タンパク質は生命活動の重要な担い手です。生体内でのタンパク質のはたらきに異常がみられた時、病気になります。そのため、病気に関わるタンパク質を対象に薬の開発が行われ、治療に用いられています。タンパク質のはたらきを三次元レベルで詳細に理解することは、薬の開発にとって重要です。
タンパク質の立体構造を数十ピコメートル(ピコメートルは1兆分の1メートル)の正確さで決める!
タンパク質は19種類のL-アミノ酸とグリシンがペプチド結合によってつながったポリペプチドで、アミノ酸の配列は遺伝子の塩基配列にしたがって、細胞の中のタンパク質合成工場であるリボソーム(平成21(2009)年のノーベル化学賞はこの巨大分子の立体構造をX線結晶構造解析で決めることに成功した3名の科学者に与えられました)で作られます。その長さは数十残基から数千残基と多様です。タンパク質の長いポリペプチド鎖は、①そのアミノ酸配列によって自発的に、もしくは②タンパク質の折りたたみを助ける分子シャペロンと呼ばれるタンパク質の働きを借りて、もしくは③相互作用するタンパク質に出合ったときお互いの相互作用を通して、折りたたまれ三次元的に固有の立体構造をとり働きます。私たちは主にX線結晶構造解析法により、免疫およびDNAに関わる重要なタンパク質の立体構造を数十ピコメートルの正確さで決定して、それらが働く仕組みを原子の位置のレベルで調べています。
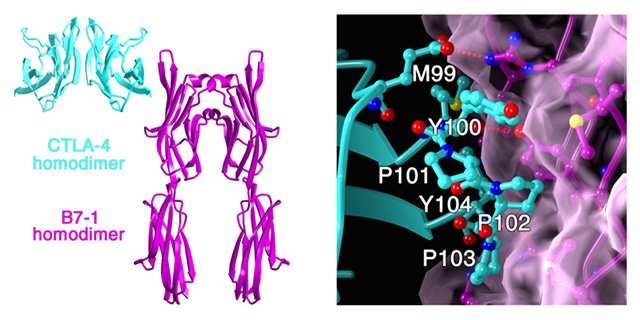
免疫により身体を守る仕組みがわかり、その情報を治療に利用!
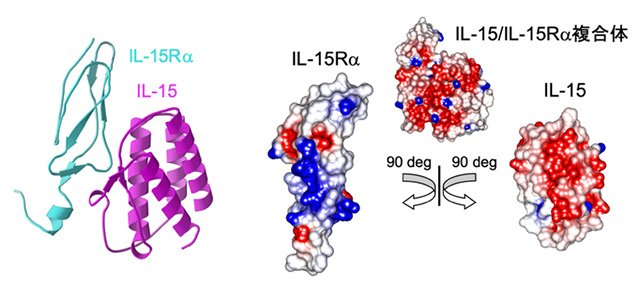
ヒトはウイルスなどの外部由来の物質から免疫により守られており、T細胞は免疫応答を司る主要な細胞です。ウイルスなどの外部由来物質の侵入を認識すると、T細胞は抗原に対する機能を手に入れ、そのT細胞を増やすことにより侵入した抗原を排除する免疫応答を誘導します。B7-1はT細胞の調節に関わる分子であり、CTLA-4はB7-1の阻害型受容体です。B7-1、さらにB7-1がCTLA-4と結合した状態の構造解析を行い、T細胞を調節する仕組みを明らかにしました(図1)。CTLA-4は2018年に本庶佑博士と同時にノーベル医学生理学賞を受賞したJames Allison博士により発見されました。CTLA-4は制御性T細胞の上にも存在しており、制御性T細胞を抑制的に制御することにより、自己への攻撃を阻害しています。CTLA-4の遺伝的な変異をもつ人がおり、自己免疫疾患の発症への影響が知られています。CTLA-4の遺伝的変異と自己免疫疾患との関係についてLondon大学のDavid Sansom教授と共同研究を進めています。 T細胞は異物を排除すると細胞死を誘導して、免疫応答を終わらせます。細胞死から逃れた一部のT細胞が記憶T細胞として生き残り、同じ抗原の二度目の侵入時に速やかに免疫応答を誘導します。IL(インターロイキン)-15は、記憶T細胞の誘導において重要なはたらきをします。IL-15受容体(R)は、IL-2と共有されるβ及びγ鎖、さらに特異的なα鎖から構成されます。IL-15がIL-15Rα受容体と結合した状態の構造解析を行い、記憶T細胞を誘導する仕組みを明らかにしました(図2)。 免疫応答に関わるタンパク質は、ほぼ全ての細胞上に存在しています。いくつかのウイルスは感染する宿主の免疫タンパク質と似たタンパク質をウイルス表面にもち、そのウイルスのタンパク質が宿主の免疫タンパク質と結合することにより感染します。免疫タンパク質の構造に関する知見を用いて、家畜に対するワクチンの開発を英国Pirbright研究所とOxford大学との共同研究を進めています。
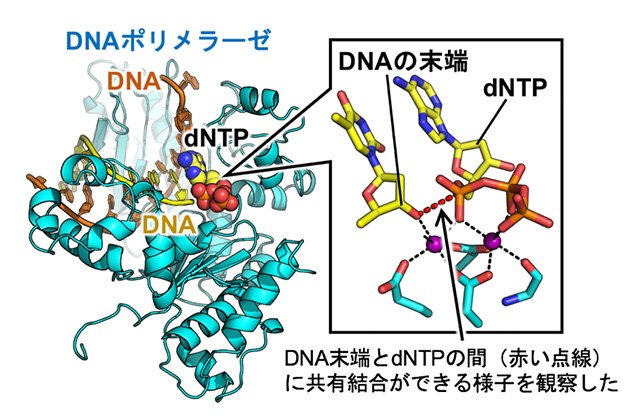
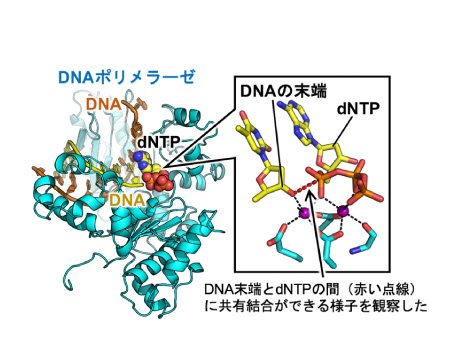
DNA合成の仕組み、DNAの損傷を見分ける仕組みがわかる!
遺伝情報を担うDNAの合成は、生命活動における重要な生体内反応の一つに挙げられます。DNAは、塩基、糖、リン酸からなるデオキシリボヌクレオチドが直鎖状に繋がったもので(DNA鎖と呼ばれる)、2本のDNA鎖が二重らせん構造を形成して、遺伝情報は保持されています。DNAポリメラーゼは、DNAの原料であるdNTP(デオキシリボヌクレオシド三リン酸)をDNA鎖の末端に連結する合成反応を繰り返すことで、DNA鎖を伸長します(図3)。タンパク質の動きを連続したスナップ写真のように撮影する「時分割」構造解析法を確立することで、DNAポリメラーゼが行うDNA合成反応を反応開始から終了まで詳細に観察しました。その結果、DNAポリメラーゼが立体構造を変えながら、DNA鎖とdNTPとの間に共有結合をつくる様子、すなわちDNA合成の起こる瞬間を観察することができ、DNA合成の仕組みが原子レベルで明らかになりました。
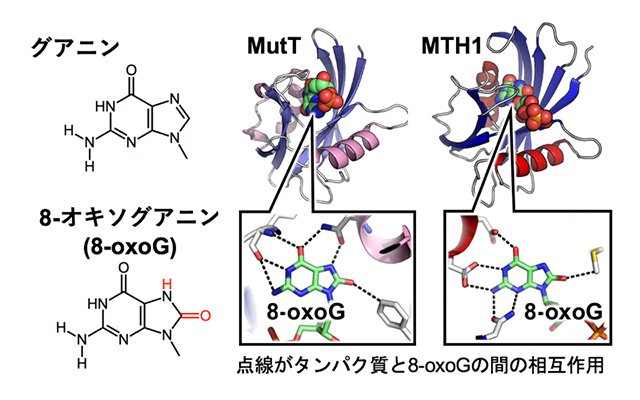
またDNA塩基は、化学的に不安定で修飾を受けやすく、例えば、グアニン塩基が活性酸素により酸化された8-オキソグアニン塩基(8-oxoG)は、突然変異の原因となります (図4)。生物は8-oxoGを取り除くタンパク質を有しており、MutTとMTH1というタンパク質は8-oxoGをもつdNTP(8-oxo-dGTP)を分解することで突然変異を抑制しています。MutTとMTH1の立体構造を決定することで、これらタンパク質が8-oxoGの形を認識し、しっかりと捕まえて分解するというDNA損傷を見分けて取り除く仕組みが明らかになりました(図4)。