薬剤学
アルブミンDDS
ヒト血清アルブミンを担体とした次世代型DDS
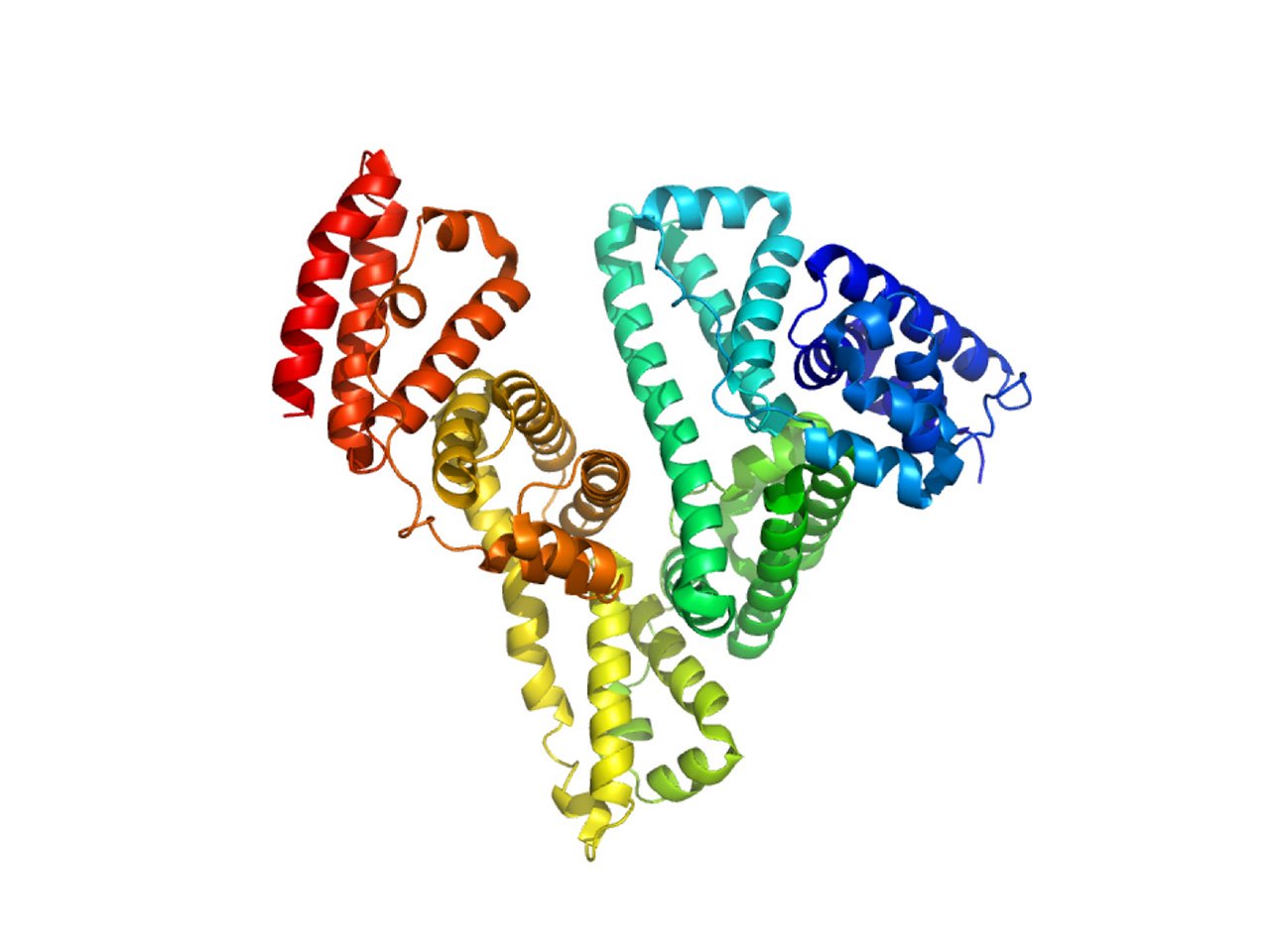
HSAは血漿中に最も豊富に存在するタンパク質であり、多様な生理活性を介して体の恒常性を維持しています(図1)。例えば、血漿浸透圧の80%がHSAによって調節されています。実際に、医療現場では循環血漿量の確保や、浮腫を改善する目的でHSAは繁用されてきました。従来、アルブミン製剤としては、貴重な献血から単離したHSAを利用してきましたが、最近では微生物の1種である酵母にHSAの遺伝子を組込み、大量に作り出す技術(遺伝子組み換え)が開発され、医療用医薬品として使用されている遺伝子組換えアルブミン製剤の製造にも活用されています。
HSAは他のタンパク質と異なり、薬物やホルモンなど多くの物質と結合することができます。また、安全性が高いため、古くからドラッグデリバリーシステム(DDS)の担体として用いられてきました。DDSとは、生体内での薬の動きを精密にコントロールする新しいクスリの投与形態です。つまり、薬を「必要な時間」に「必要な量」だけ「必要な場所」に送り届ける画期的な運搬システムであることから、しばしば「クスリの宅配便」に例えられます。
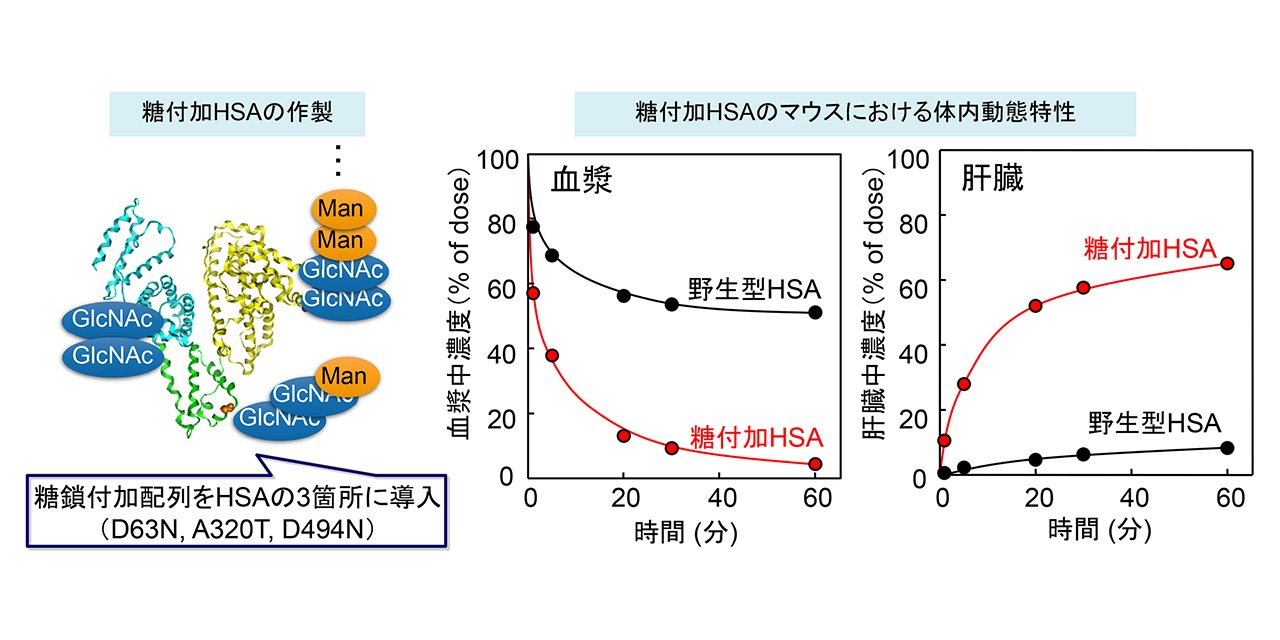
現在、我々は遺伝子組換え技術を活用してHSAの一部を改変し、これをDDSの担体とすることで、既存のDDS技術の限界を克服した次世代型DDS(アルブミンDDS)の確立を試みています。ここでは、アルブミンDDSの一例として、糖付加HSAによる臓器・細胞標的化について簡単に紹介します。
高マンノース付加型HSAによる肝マクロファージ選択的DDSとアルブミン融合技術
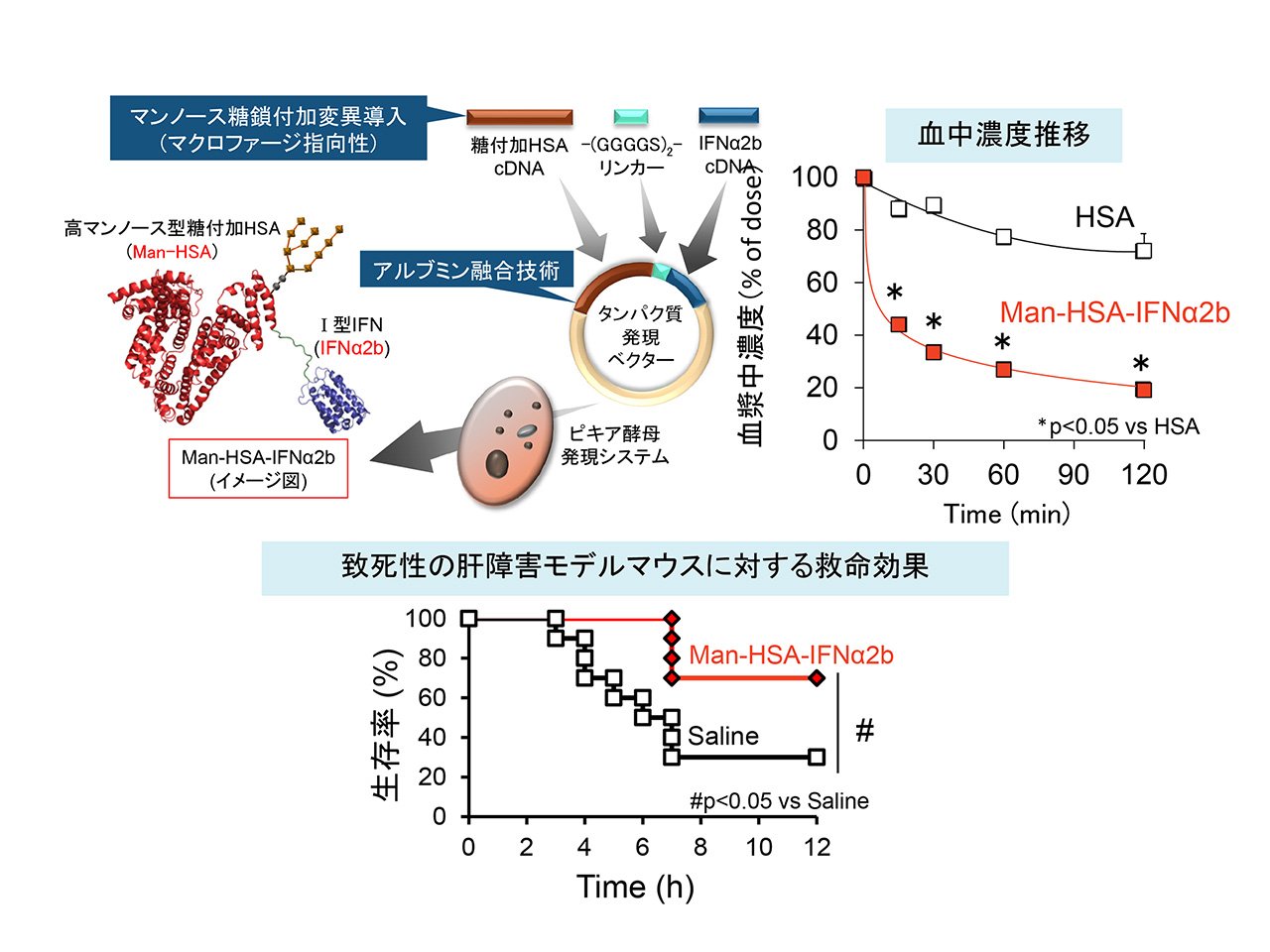
現在までのところ、世界中で60種を超えるHSA変異体が発見されていますが、興味深いことに通常のHSAとほぼ同様な特徴を保持しています。我々は、このHSA変異体に注目し、アルブミンDDSの担体としての可能性を追求しています。例えば、HSAはアミノ酸からのみ成り立つ単純タンパク質であり、糖鎖を有していません。ところが、アミノ酸の変異に伴い糖鎖を有するHSA変異体が3種類存在します。そこで、これらの糖付加HSA変異体を組み合わせ、マンノースと呼ばれる単糖を高密度に発現する遺伝子組み換え糖付加アルブミンの創製に初めて成功しました。この糖付加アルブミンを生体に投与すると、肝臓のマクロファージ表面に存在するマンノース受容体によって認識され、肝臓内に素早く取り込まれます。我々は、この特徴を生かして肝マクロファージ選択的DDSを確立しました(図2)。1型インターフェロン(IFN)は抗ウイルス作用など多彩な生物活性を有しており、C型肝炎治療薬をはじめとする多面的な医薬品開発が展開されています。近年、この1型IFNがマクロファージに作用すると抗炎症・免疫調節因子を誘導することが見出されました。そこで我々は、1型IFNと糖付加アルブミンを遺伝子レベルでの融合(アルブミン融合技術)により、肝マクロファージ指向性1型IFNを創製しました(図3)。本融合体は急性及び慢性肝疾患に対して優れた治療効果を発揮したことから、肝炎治療薬としての活用が期待されます。
おわりに
アルブミン融合技術の魅力は、上述した以外に、動態特性、酸化還元緩衝能、抗酸化作用など、数多くの分子特性をHSAが有している点にあり、融合化させるタンパクの効果を相乗的に高めます。さらに、遺伝子組換え技術により臓器・細胞標的化も容易です。臨床応用を見据え、今後もアルブミンDDSの発展に従事したいと考えています。
慢性腎臓病の新たな診断法と治療薬開発
慢性腎臓病の現状と課題
慢性腎臓病(chronic kidney disease: CKD)は、進行すると末期腎不全に陥り、透析導入や移植を必要とします。同時に合併症として心血管疾患や全身の筋力低下(サルコペニア)などを発症することで死亡リスクが上昇します。現在、日本において成人の8人に1人がCKDであると言われており、透析患者数も33万人を超えた。透析患者の年間医療費は1兆5千億円(一人あたり年間500万円)を超えることから、CKD患者数の増加は医療経済的にも大きな問題となっています。しかしながら、その根本治療は未だ確立していません。したがって、CKD病態を制御するために、病態進展機序の解明とその分子機序にもとづいた新たな診断法と治療薬の開発が求められています。ここでは、CKDに対する私達の研究について紹介します。
CKDと酸化ストレスの関係:診断マーカーとして酸化ストレスを測定する
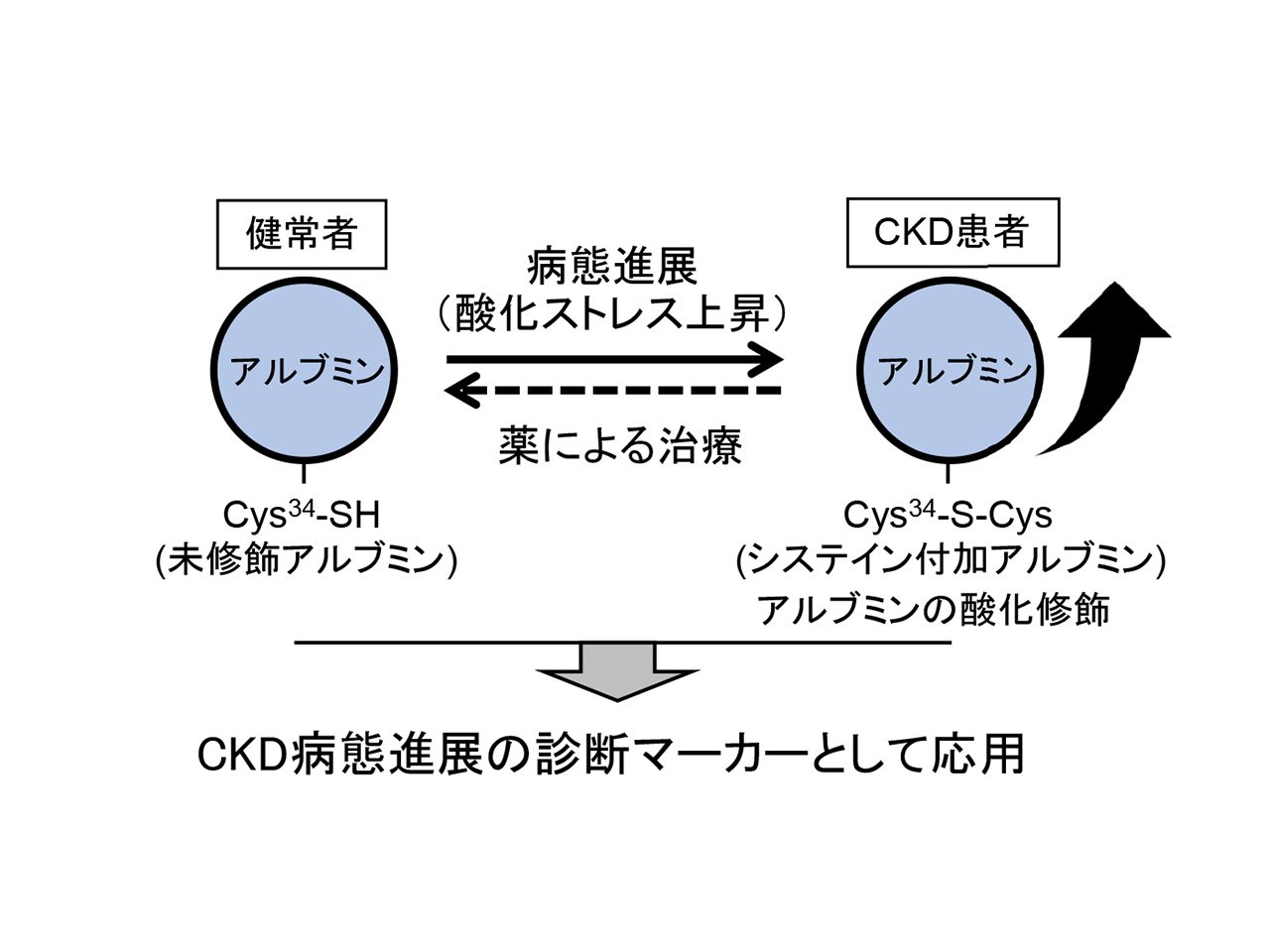
これまで、CKDの進展には酸化ストレスの関与が示唆されてきました。酸化ストレスとは、活性酸素の産生にともなう生体障害作用と、それを解毒して障害を修復する生体作用との間で、バランスが崩れた状態のことです。また、最近では酸化ストレス抑制薬であるバルドキソロンメチルが、世界で初めて糖尿病に起因するCKDに対して腎機能改善作用を示すことが報告されました。この知見はCKD患者における酸化ストレス評価の重要性を示唆するものです。しかしながら、これまで臨床検査に応用可能な酸化ストレス評価系は存在しませんでした。私達は質量分析装置を用いて血清タンパク質の一つであるアルブミンの翻訳後修飾体を測定した結果、腎病態の進展に伴い、1分子のアルブミンに1分子のシステインが付加した酸化型のアルブミンが上昇することを発見しました。また、本測定法は、早期のCKD病態予測マーカーとして利用可能であることを明らかにしました (図1)。
CKD合併症としての心血管疾患発症メカニズム
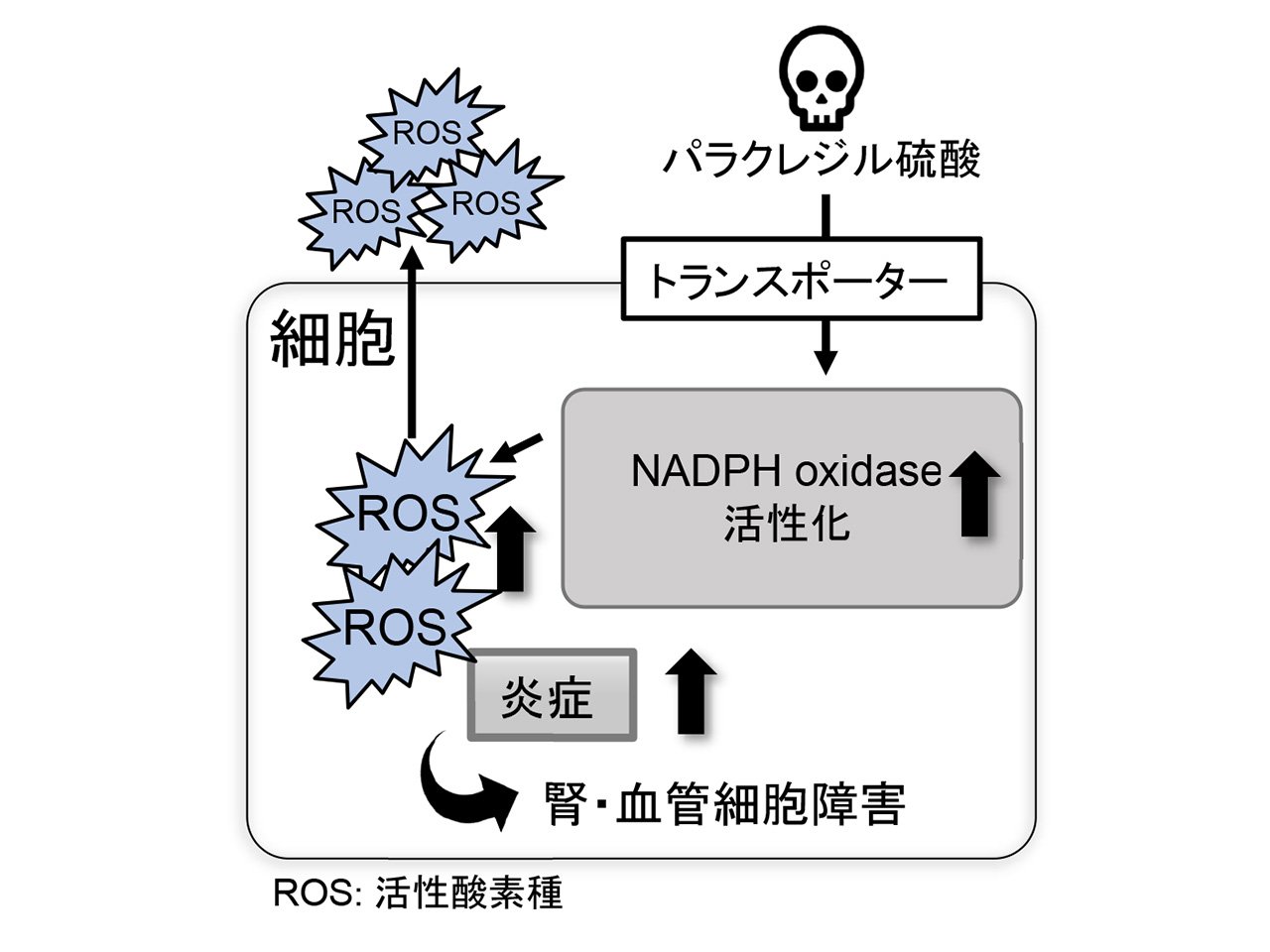
CKD病態では、本来腎臓から排泄されるべき有毒な物質が体内に蓄積してきます。このような物質を総称して尿毒症物質と呼びます。パラクレジル硫酸は、2005年に同定された尿毒症物質です。複数の臨床試験の結果より、その血中濃度の上昇がCKDの進展並びに心血管疾患合併症と関連することが報告されてきました。しかしながら、パラクレジル硫酸が関わる病態進展の分子機構については不明でした。私達は腎細胞、血管細胞並びにCKDモデル動物を用いた検討より、パラクレジル硫酸の毒性発現過程において、トランスポーターを介した腎及び血管細胞内取り込みと、その後のNADPH oxidase活性化に伴う活性酸素種の産生と炎症が関わることを明らかにしました(図2)。
CKDが誘発するサルコペニアの分子機構と治療戦略
CKDに伴う筋萎縮・筋力低下(サルコペニア)は、生命予後とも関連します。従って、CKD患者におけるサルコペニア対策は喫緊の課題とされています。しかしながら、その分子機構については不明な点が多くありました。私達は尿毒症物質の中でも、インドキシル硫酸がトランスポーターを介して筋細胞に取り込まれた後、NADPH oxidaseの活性化を経て筋細胞の増殖・分化を抑制することを発見するとともに、運動能力に関わるミトコンドリア障害を誘発することを見出しました。一方でCKDモデル動物を用いた検討より、インドキシル硫酸の血清中濃度を低下させるAST-120(多孔性球状活性炭)、骨格筋のミトコンドリアを活性化するカルニチンや糖尿病治療薬のテネリグリプチンの投与が、筋萎縮と運動機能を回復させることを発見しました。
酸化ストレスを標的としたCKD治療薬の開発
上述してきたような腎病態で誘発される酸化ストレス・炎症を標的とした新規治療戦略として、血中滞溜型の新規抗酸化・炎症制御薬(アルブミン-チオレドキシン融合タンパク質:HSA-Trx)を開発し、腎病態への応用を試みてきました。HSA-Trxは臨床上問題となっている急性腎臓病(acute kidney disease: AKI)に加え、地震等の大規模災害で問題となっている横紋筋融解症誘発AKIモデル動物に対して高い効果を示しました。加えて、集中治療室での生存率に寄与するとされる「AKI誘発の多臓器(肺や肝臓)障害」に着目し、血中滞溜性を活かしたHSA-Trxの治療的応用について検討したところ、本モデル動物の生存率を上昇させることに成功しました。
献血由来廃棄血漿からのCKD治療薬候補の発見
最近、私達は献血由来の廃棄血漿中に含まれるα1-酸性糖タンパク質(alfa1-acid glycoprotein: AGP)に、炎症抑制作用があることを見出し、CKD進展抑制効果を有することを発見しました。具体的には、厚生労働省の許可のもと献血由来廃棄血漿からAGPを精製し、CKDモデル動物に投与した際、CKD病態の進展が抑制されることを明らかにしました。
おわりに
CKDに対する根治療法は未だ存在しません。一方、CKD患者で上昇する酸化ストレスや炎症を標的とした治療戦略が注目を浴びるようになってきました。私達は、CKDの診断と治療に貢献すべく、1)CKDに関わる酸化ストレスについて、質量分析装置を用いた評価方法、2)CKDの病態進展因子としての尿毒症物質の関与とその分子機構、3)CKDを制御するための抗酸化・炎症制御薬の開発を展開してきました。今後も臨床医や製薬企業とも協力しながら、その病態制御に向けた課題解決に貢献したいと考えています。