Yamagata et al., Cell,86,311(1996)[Medline]
1.遺伝情報維持に働くタンパク質の構造生物学
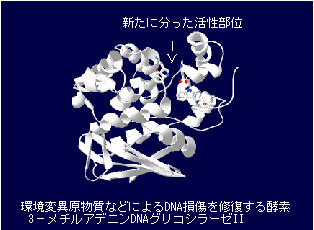
私達は変異原物質であるアルキル化剤によるDNAの損傷を治すDNA修復酵素のX線結晶構造解析を行い、まったく分っていなかった酵素の活性部位を推定、変異型DNA修復酵素を作りそれらの活性を測定することによって活性部位を証明、コンピュータグラフィックスを用いてDNAの損傷を治す仕組みを明らかにした。また、他の多くのDNAグリコシラーゼも良く似た構造をもつこと、すなわち、DNAグリコシラーゼスーパーファミリーの存在を明らかにした。このことから他の様々な有害物質によるDNAの損傷を修復する酵素についてもそれらの働く仕組みが推定できるようになった。DNAの損傷は突然変異やガンの原因になりますので、それらをおさえる仕組みの一つを解明できた訳である。

Yamagata et al., Cell,86,311(1996)[Medline]
2.タンパク質の安定化機構の解明
蛋白質の変性のギブス自由エネルギー変化量が高々40 kJ/mol という僅かのエネルギー差で安定性が保たれており、僅かの構造の変化で安定性が大きく変化する。実際、一残基置換であっても安定性が著しく変化したり、同じアミノ酸の置換であっても、置換部位によって安定性の変化は著しく異なっている。従って、変異型蛋白質の安定性の変化を理解するためには、個々のアミノ酸の立体構造上の特徴の変化と安定性の変化を関連づける必要があるが、これが極めて困難な課題であった。
我々は、個々のアミノ酸の立体構造上の特徴の変化と安定性の変化を関連づけるためには、系統的、網羅的なアミノ酸変異型蛋白質を用い、天然状態での立体構造の変化をX線結晶構造解析で、熱安定性をカロリメトリーで明らかにし、構造変化と熱安定性の相関を調べ、蓄積されたデータを基に「構造と安定性」の定量的な相関関係を得ること以外に道はないと判断した。
そこで、特定領域研究「タンパク質立体構造の構築原理」が推進された4年間〔平成7-10年度〕を中心に、系統的で網羅的な変異型ヒトリゾチームについてX線結晶構造解析と熱測定を行った。現在までに約130種の変異型の安定性と立体構造のデータがそろった。これらの中で疎水性残基の変異型のデータからは、アミノ酸置換による安定性の変化(DDG)が、変性により溶媒に露出する分子全体の疎水性残基の溶媒露出面積(ASA)の置換による変化と相関をもつこと。さらに、置換残基の2次構造の傾向性、分子内部の水分子も安定性に寄与することがわかった。水素結合が変化する変異型からは、水素結合の種類別に寄与の程度が異なることがわかった。さらに、これら変異型の安定性の変化は、これまでに示してきた個々の安定化因子の総和として、次式の構造関数で表せることを見いだした。
DDGexp = DDGHP + DDGconf + DDGHB + DDGH2O + SDDGi
= aDDASAnonpolar + bDDASApolar + (-TDDSconf) +
gWWiSrHB(WW)-1 + gWPiSrHB(WP)-1 + gPPiSrHB(PP)-1 + diDnH2O + SDDGi
この研究は大阪大学蛋白質研究所油谷克英博士のグループとの共同研究である。
Y. Yamagata, M. Kato, K. Odawara, Y. Tokuno, Y. Nakashima, N. Matsushima, K. Yasumura, K. Tomita, K. Ihara, Y. Fujii, Y. Nakabeppu, M. Sekiguchi and S. Fujii (1996) "Three-Dimensional Structure of a DNA Repair Enzyme, 3-Methyladenine DNA Glycosylase II, from Escherichia coli" Cell 86, 311-319 [Medline]
3−メチルアデニンDNAグリコシラーゼIIのX線結晶構造解析によって明らかになった3次元構造から活性部位の推定と変異実験によるアルキル化塩基の除去修復機構の解明とDNAグリコシラーゼスーパーファミリーの存在を示し、その後のDNAグリコシラーゼ研究に大いに役立っている。
Y. Yamagata, K. Ogasahara, Y. Hioki, S.J. Lee, A. Nakagawa, H. Nakamura, M. Ishida, S. Kuramitsu and K. Yutani (2001) "Entropic stabilization of the tryptophan synthase alpha-subunit from a hyperthermophile, Pyrococcus furiosus: X-ray analysis and calorimetry." J. Biol. Chem. 276, 11062-11071 [Medline]
超好熱菌由来の蛋白質の安定化機構を調べたもので、結論としては個々の蛋白質によって安定化に寄与している因子とその寄与の度合いは異なるが、それぞれの因子の総和であるということを示した。
K. Takano, Y. Yamagata and K. Yutani (2001) "Contribution of Polar Groups in the Interior of a Protein to the Conformational Stability" Biochemistry 40, 4853 - 4858 [Medline]
従来の考えの異なり、蛋白質内部に存在する親水性残基が蛋白質の安定化に働くということを示した。
K. Takano, Y. Yamagata and K. Yutani (1998) "A General Rule for the Relationship between Hydrophobic Effect and Conformational Stability of a Protein: Stability and Structure of a Series of Hydrophobic Mutants of Human Lysozyme" J. Mol. Biol. 280, 749-761 [Medline]
蛋白質の熱安定性に果たす疎水性の寄与を定量的に見積もることができた。
K. Takano, Y. Yamagata, J. Funahashi, Y. Hioki, S. Kuramitsu and K. Yutani (1999) "Contribution of Intra- and Intermolecular Hydrogen Bonds to the Conformational Stability of Human Lysozyme" Biochemistry 38, 12698-12708 [Medline]
蛋白質の熱安定性に果たす水素結合の寄与を定量的に見積もることができた。