
 |
研究対象はいくつかありますが、「タンパク質の機能に関する研究」という点で、一貫しています。分析化学・生化学・分子生物学・物理化学的手法を用いて、生体分子の分子間相互作用を詳細に解析します。 |
〜新薬を創る・病気の状態を調べる・治療法を開発する〜
一本鎖抗体とは?
生体内で、異物を認識するタンパク質である抗体。抗体分子のうち、抗原(異物)を認識する場所が可変領域(Fv領域)といわれる部分である。このFv領域に着目します。Fv領域は、分子量の小さいL鎖由来のVL部分と分子量の大きいH鎖由来のVH部分の2本のペプチドから成る。この2本をリンカー(十数個のアミノ酸からなるペプチド)でつないだ、一本鎖抗体を遺伝子組み換えの手法を用いて作製する。一本鎖抗体は、本来の抗体よりも分子量が小さいため、細胞内で速やかに動き、その効果を発揮する。低分子量という性質は、解析が容易で、薬として応用する際には安価に製造できるという利点もある。
医療分野における一本鎖抗体の活用法
一本鎖抗体の大きな特徴は、抗原を認識する、つまり標的分子をとらえることができる(ターゲティング)機能をもつタンパク質である。抗原が病気に関与する物質である場合、一本鎖抗体は、その病気にかかっているかどうかの診断(病態解析)や、その分子のはたらきを抑える薬としての利用につながる可能性がある。
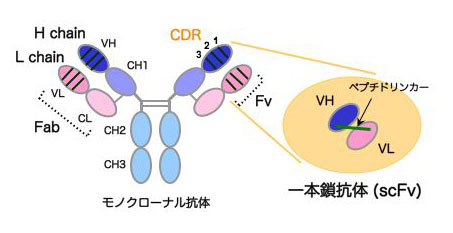
抗体(IgG)と一本鎖化抗体(scFv)
一本鎖抗体を用いた応用研究もある。一本鎖抗体に、ある波長の光を当てるとより長い波長のより強い光(蛍光)を発する分子をつけた機能性タンパク質を作製する。このタンパク質の蛍光を追いかけることで、一本鎖抗体が細胞内のどこにあるのかがわかる。これにより以下のようなことができるようになる。
(1) 抗体の標的となっている、病気に関与する分子が、体内のどこに集まっているかがわかる。
(2) ある薬を投与した際に、病気に関与する分子の体内での分布や量がどのように変化するかがわかる。すなわち、薬の効果を知ることができる。
(3) 抗体を薬として利用したときには、薬の体内での動きや変化(薬物動態)がわかる。
(4) 蛍光化合物ではなく、薬を抗体につけた場合には、病気の部分(病変部)に選択的に薬を送り届けることができます。それにより、副作用を減らすことができる。
しかしながら、抗体分子は不安定であり、そのまま体内に入れても機能しないことがある。そこで、抗体分子の体内での安定性を向上させるための方法の開発や、より結合が強い抗体を人為的に設計していくために、抗体とその標的分子との間の結合様式の詳細な解析を行っている。
扱う抗体分子は様々である。糖尿病、動脈硬化症、がん、リンパ腫、色素性乾皮症など、様々な疾患に関連する分子を標的とした抗体分子の研究を、全国の様々な研究機関と共同で進めている。このように新たな抗体分子を、創薬につなげることを目指して研究している。
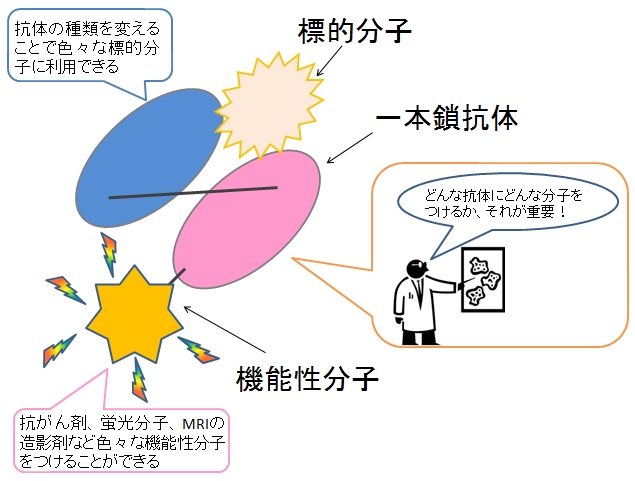
機能性一本鎖抗体.
様々な標的分子に対する、様々な抗体に、様々な機能性分子をつけることで、様々な応用が考えられる
〜抗体分子の工学的応用へ向けて〜
一本鎖抗体の工学的応用を目指した研究も行っています。ダイオキシン類やPCB類は水や大気、海洋、食品等に広く含まれる環境汚染物質です。発がん性や胎児の奇形を引き起こす原因となることが動物実験から明らかにされています。環境ホルモンとしても、微量でも作用することが知られており、生態系への影響が問題となっています。ダイオキシンやPCBは特定の化学構造を持つ物質の総称であり、その微妙な化学構造の違いにより毒性や生態系への影響の強さも変わります。そのため、どのような化学構造を持ったPCBやダイオキシンがどの程度食品や環境等に含まれているかを知ることは重要です。化学構造の違いが微妙な物質を見分け、その濃度を測定することは難しいのが現状です。そこで、私たちは特定の物質のみを見分け、その濃度を測る道具として、抗体を利用したセンサー素子の開発を行っています。
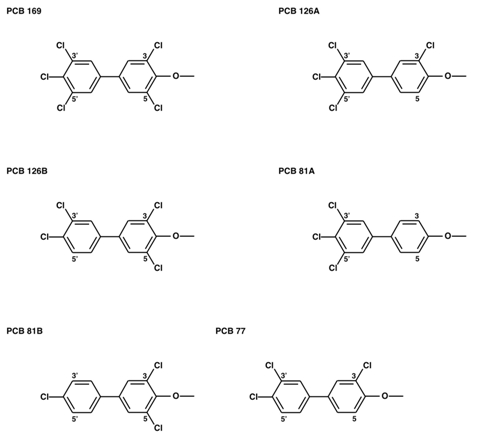
PCBの化学構造 (一部のみを例示)
〜タンパク質の構造と機能の関係を解析する〜
PCNA(Proliferating Cell Nuclear Antigen;増殖細胞核抗原)というタンパク質があります。これは、DNAの複製や修復に関与するタンパク質です。また、細胞周期の調節にも関わっています。PCNAはDNAの上に存在し、DNAに作用するさまざまな酵素の足場として、酵素のはたらきを促進します。
病気の多くは、DNA複製や修復、あるいは細胞周期の異常により引き起こされます。これらに関与するPCNAの構造と機能の関係を明らかにすることは、DNA合成というしくみを明らかにするとともに、さまざまな病気を解析する研究にも役立ちます。
PCNAはその独特な構造と機能から「スライディング・クランプ(sliding clamp)」と呼ばれるタンパク質の仲間です。クランプとは、棒状のものを固定するリング状(またはコの字形、C字形)の部品や工具につけられた名前です。PCNAはリング状のタンパク質で、DNAの二本鎖は中央の穴を通っています。DNAの複製や修復が起こる時、PCNAはそれぞれの機能に関与するタンパク質と結合し、輪の中にあるDNAに沿ってスライドしながら結合したタンパク質がはたらくのを促進します。<下図参照>
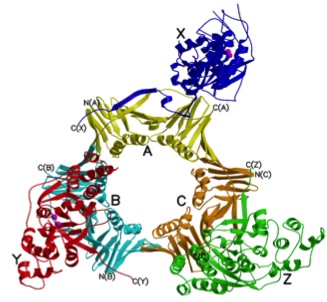
(a)PCNAのリング構造
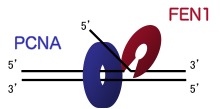
(b)スライディング・クランプ
(a)PCNAにFEN-1というDNA切断酵素が結合している複合体の立体構造(X線結晶構造解析)。中央のリングをDNA二本鎖が通り、PCNAはDNA上をすべるように動く
(b)PCNAに結合したFEN-1がDNAを切断するイメージ図。FEN-1は、二本鎖DNAから一本鎖DNAが枝分かれした部分を認識して、その部分を切り落とすはたらきをする。
わたしたちのグループでは、これまでPCNAのさまざまなアミノ酸に変異を導入し、その機能の解析を進めてきました。最近、PCNAのリングの内側にあるいくつかのアミノ酸の変異を導入して、DNAの上での動きが遅いPCNA変異体を作製しました。動きが遅いという性質から、これまで困難だった解析が可能となってきています。(1)速度論的な解析、(2)水溶液中での解析(蛍光相互相関分光法;FCCS)、(3)ゲルモビリティシフトアッセイおよびフットプリンティングアッセイ、(4)蛍光共鳴エネルギー移動(FRET)による解析など、さまざまな分析手法を駆使して、自然の摂理に迫ります。
〜血液透析療法に一石を〜
現在の血液透析療法では、低分子の水溶性の毒素の除去が可能です。しかし、ビリルビンのような高分子の毒素は、血液中の主要なタンパク質であるアルブミンに結合するためその除去は困難です。このようなアルブミンに対して高い結合性がある毒素は、アルブミン結合毒素(ABT)と呼ばれます。新たな透析療法として、透析液にアルブミンを循環させ結合毒素を引き抜くアルブミン循環透析法(ECAD)が注目されてきています。しかし現状では、アルブミンによる引き抜き効果が充分に得られず、毒素の除去が不十分という問題があります。まだまだ臨床効果が低く問題が多いこの透析法を、より効率的なものに改良することが望まれています。
わたしたちのグループでは、ファージディスプレイ法という方法を用いて、アルブミン結合毒素(ABT)に対してより高い親和性を示す、機能性ヒト血清アルブミンの開発研究を行っています。ファージディスプレイ法では、アルブミンが薬物と結合する部位を分子表面に提示させることができるため、アルブミン結合毒素(ABT)を効果的に取り除くことができます。医療に役立つ、すぐれた血液透析療法用の素材の開発と機能の評価を行っています。
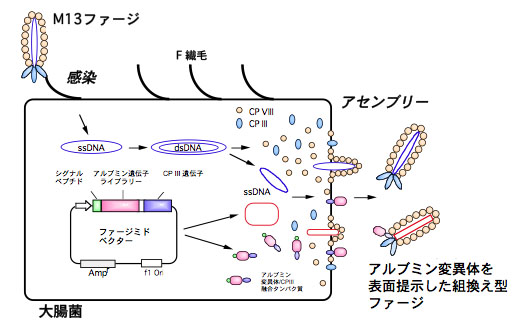
ファージディスプレイ法によるアルブミン変異体の作製
〜新しい抗がん剤を求めて〜
チロシンキナーゼとは
チロシンキナーゼは、タンパク質を構成するアミノ酸の1種であるチロシンのリン酸化を触媒する酵素である。ヒトを含めた多細胞生物のみに存在し、細胞の分化,増殖、接着、免疫反応など様々な生体反応の引き金となっている。チロシンキナーゼには不活性型と活性型の2つの状態がある。通常は不活性型として存在しているが、細胞の外からの刺激により不活性型から活性型へと変化し、機能が発揮される。通常の細胞ではチロシンキナーゼの活性は厳密に制御されている。何らかの理由により、その制御が効かなくなって暴走を始めてしまうと、無秩序に細胞が増え続けたり、無秩序に免疫反応が起こり、がんを始めとして様々な病気になる。そのため、チロシンキナーゼは薬の標的として重要なタンパク質となっている。実際、チロシンキナーゼを標的とした薬が臨床現場で数多く用いられている。例えば、慢性骨髄性白血病や消化管質腫瘍 (GIST)の治療に用いられるグリベック、タシグナ、スプリセル、非小細胞肺癌の治療に用いられるイレッサ、タルセバ、腎細胞がんの治療に用いられるスーテント、ネクサバールなどが挙げられる。しかし、それらの抗がん剤を使用していると、薬が効かなくなってくることがある。
私たちのグループでは、それらのチロシンキナーゼ阻害薬が効かなくなるのはなぜなのか、という疑問を原子レベル、分子レベルで理解することを目指して研究を行っている。それにより、新しい抗がん剤の開発が進むことが期待される。
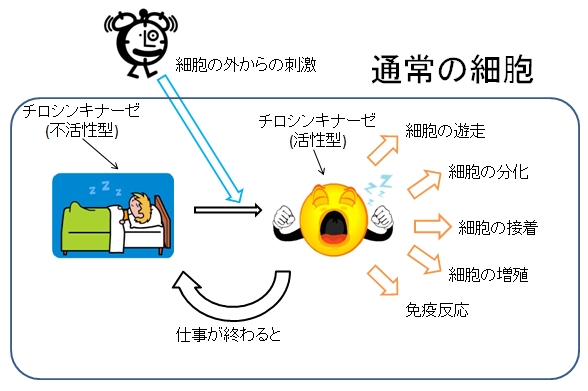
(a) 正常細胞でのチロシンキナーゼの役割
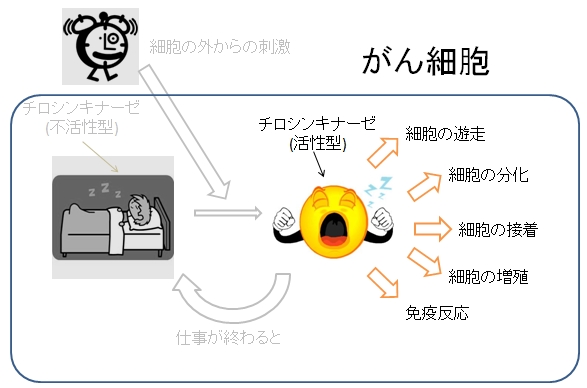
(b) がん細胞でのチロシンキナーゼの役割
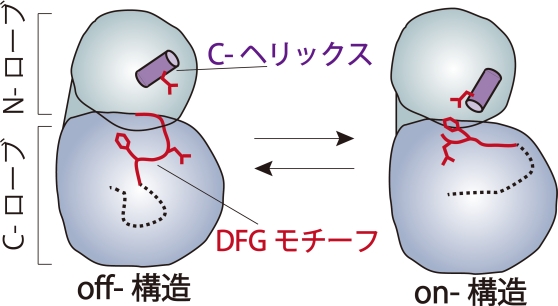
(c) チロシンキナーゼの機能を制御する動き
(a)通常の細胞では活性が制御されており、細胞の外からの刺激に応じて活性型へと変化する
(b)がん細胞では、細胞の外からの刺激とは無関係に常に活性型である
(c)チロシンキナーゼは局所的な立体構造の変化により活性が制御される
〜ミクロの世界からマクロの世界へ〜
クロマチン再構成とは
ヒトの遺伝子を構成するDNAは全長2m程度と言われており、それが10μmという微小な細胞核内に格納されている。核内には、ヒストンと呼ばれるタンパク質から構成される、糸巻きのような構造体が無数に存在しており、DNAはそれらに巻き取られることによってコンパクトに収納されている。発生や細胞分裂など様々な過程において、そこに関わるタンパク質が遺伝子から作られる必要がある。遺伝子からタンパク質が作られる際には、目的遺伝子の部分が糸巻きからほぐされ、引き出されてくる必要がある。この過程をクロマチン再構成と呼ぶ。私たちの細胞内では、複数の種類のタンパク質からなるクロマチン再構成複合体がクロマチンの再構成を担っている。クロマチン再構成複合体を構成するタンパク質間の相互作用を解析し、3次元構造を解析することで、「クロマチン再構成複合体がどのようにして糸巻きからDNAをほぐすのか」というなぞを分子レベル、原子レベルで解き明かそうと、機能分子構造解析学分野と生命分析化学分野では、共同で研究を行っている。
遺伝子は紫外線や活性酸素、放射線など、多種多様なストレスにさらされており、損傷と修復が常に行われている。遺伝子の損傷が修復されなければがんを始めとして様々な病気が引き起こされる。クロマチン再構成は遺伝子の修復にも関わっており、そのメカニズムを原子レベルで理解することにより、病気のメカニズムの解明や、薬につながる新たな分子メカニズムの発見につながることが期待される。
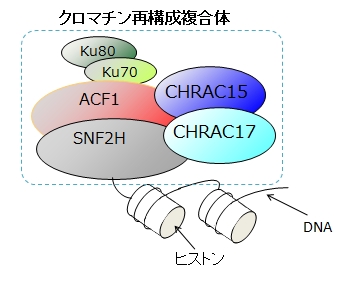
クロマチン再構成複合体