田原春 徹 (タハラバル トオル、TAHARABARU Toru, Ph.D.)
■経歴
1996 年 鹿児島県生まれ
2015 年 3 月 鹿児島市立 鹿児島玉龍中高一貫教育校 卒業
2015 年 4 月 熊本大学 薬学部 創薬・生命薬科学科 入学
2019 年 3 月 熊本大学 薬学部 創薬・生命薬科学科 卒業
2019 年 4 月 熊本大学 大学院薬学教育部 博士前期課程 入学
2021 年 3 月 熊本大学 大学院薬学教育部 博士前期課程 修了
2021 年 4 月 熊本大学 大学院薬学教育部 博士後期課程 進学
2021 年 4 月 日本学術振興会 特別研究員DC1 (2023 年 9 月まで)
2022 年 3 月 National University of Singapore へ研究留学
(日本学術振興会 若手研究者海外挑戦プログラム、2023 年 3 月まで)
2023 年 9 月 熊本大学 大学院薬学教育部 博士後期課程 修了
2023 年10月 日本学術振興会 特別研究員PD (当分野博士研究員、2024 年 3 月まで)
2024 年 4 月 大塚製薬株式会社 CMC本部製剤研究部 入社
2025 年 1 月 大塚製薬株式会社 CMC本部製剤研究部 退社
2025 年 2 月 熊本大学 大学院生命科学研究部/熊本大学 薬学部 助教 (現職)
■業績:業績の詳細は以下のリンクをご参照ください。
Scopus (ID: 57216798530)
Google Scholar (Toru Taharabaru)
researchmap (ID: R000083049)
■賞罰
2019 年 5 月 日本薬剤学会第34年会最優秀発表者賞
2019 年 7 月 第35回日本 DDS 学会学術集会優秀発表賞
2020 年 3 月 日本薬学会第140年会ハイライト講演
2021 年 3 月 熊本大学学長賞
2021 年 5 月 日本薬剤学会第36年会最優秀発表者賞
2021 年 7 月 新製剤技術とエンジニアリング振興基金 海外留学研究助成金 (授賞)
2021 年12月 日本薬剤学会 Global Education Seminar 2021, Presentation Award
2021 年12月 リバネス研究費 incu-be 奨励賞
2023 年 9 月 第28回創剤フォーラム若手研究会優秀ポスター賞
2023 年 9 月 第39回シクロデキストリンシンポジウム優秀ポスター賞 (高橋圭子賞)
2023 年 9 月 熊本大学学長賞
2023 年12月 日本バイオマテリアル学会2023年度九州ブロック研究発表会優秀ポスター賞
2024 年 2 月 9th Asian Conference on Coordination Chemistry, The Best Poster Award
2025 年 6 月 第 41 回日本 DDS 学会学術集会, Outstanding Presentation Award
2025 年 9 月 第 33 回DDS カンファランス, Postdoctoral Presentation Award
2025 年 9 月 第 50 回製剤・創剤セミナー, Postdoctoral Presentation Award
■研究領域
製剤学、医用生体工学、超分子化学、超分子薬学
■研究キーワード
シクロデキストリン、ポリロタキサン、ポリカテナン、ドラッグデリバリーシステム、
可動性材料、動的特性、ゲノム編集、核酸医薬、バイオ医薬品、超分子ナノロボット
■研究内容
細胞は生命活動を営む上での最小単位です。言い換えれば、私たちのいのちや身体は細胞から構成されており、体内で進行するさまざまな生理的プロセスの多くは、この細胞内で生じていることが知られています。
医薬品の候補化合物は、従来の低分子からペプチド、タンパク質、抗体、核酸、遺伝子、さらにはゲノム編集分子へとシフトしつつあります。これらのバイオ医薬品は一般に親水性が高く、中〜高分子量であるため、低分子化合物に比べて細胞内への取り込み効率が低いことが知られています。したがって、バイオ化合物の中には、標的とする細胞内へと導入する技術がなければ、その薬理効果を十分に発揮できないものがあります。また、細胞内への移行能を付与することで、その応用範囲を拡大できる可能性もあります。
このような背景を踏まえ、私はバイオ化合物を細胞内に効率よく導入し、かつ標的となる臓器 (組織) の特定細胞へと送達する Drug Delivery System (DDS) の研究に取り組んでいます。従来の DDS 技術は、長年の基礎研究により性質が明らかになった標的分子 (バイオ化合物や標的細胞) に対して、それらの構造に厳密に適合する分子―すなわち強く結合する分子を精密に設計することで構築されてきました。しかしながら、このような分子設計には非常に多くの時間とコストがかかります。私は、病に苦しむ患者様やそのご家族に一刻も早く新しい薬を届けるために、従来の DDS 技術に新たな発想を取り入れ、分子設計に要する時間的・経済的コストを削減することが重要であると考えるようになりました。
こうした考えのもと、私は「可動性材料」に着目し、新たな分子機構をもつ DDS 技術の構築を目指しています。例えば、図に示すような数珠状の超分子ポリマー「ポリロタキサン」は、貫通した軸に沿って、環状分子が回転・移動できるという特性を持ちます。このポリマーが有する秩序立った動的特性を活用し、修飾された分子が動き・変形するように分子を設計すれば、薬物や細胞表面の受容体と強く相互作用できる可能性があります。すなわち、従来のように相互作用の強い分子を緻密に設計するのではなく、ある程度相互作用できる分子を可動性ポリマーに修飾し、そのポリマーが標的分子の形に合わせて「動く」ことで、目的の相互作用を達成するという発想です。
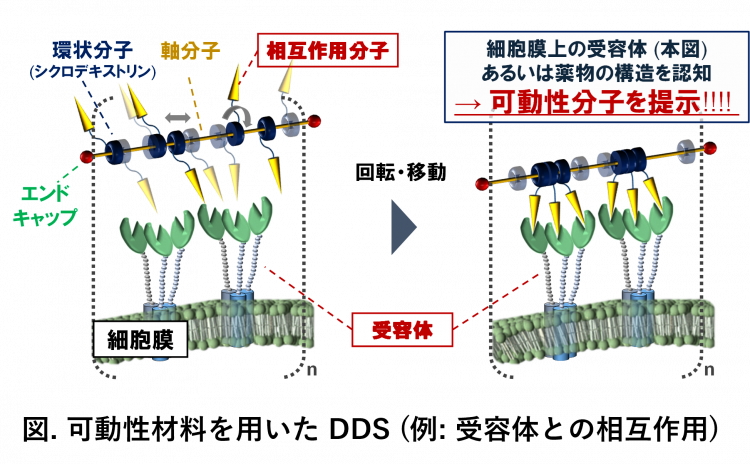
この概念をうまく応用すれば、
1) 新規バイオ化合物に対して迅速かつ高効率に DDS・製剤設計を実現できる
2) 従来技術よりも効率に優れ、コストを抑えた医薬品を創出できる
3) 従来技術では実用化に至らなかった分子に可動性を付与し、効率向上と実用化を促進できる (= 知的資源の再活用)
と考えており、このようなDDS 技術の革新により、社会や患者様へ貢献できると信じています。
現在までに、ペプチド、タンパク質、抗体、核酸、ゲノム編集分子などに対して、本概念を応用した DDS や製剤設計の有用性を明らかにしてきました (業績欄をご参照ください)。今後は、本概念による DDS の実用化に向けた研究を展開するとともに、細胞医薬への応用にも取り組みたいと考えています。
■連絡先
E-mail : taharabaru(at)kumamoto-u.ac.jp
※(at) を@に換えてください。
TEL : 096-371-4168


