数10ピコメートルの世界を覗く 〜タンパク質のX線結晶構造解析〜
山縣ゆり子教授 (機能分子構造解析学分野)
タンパク質に注目!
生命現象は、生物を構成する分子のレベルでみると、基本的には生体分子間の相互作用や生体内反応で説明できます。本分野では、生体分子の中でも特にタンパク質に注目をしています。タンパク質は3大栄養素の一つとしてよく知られていいますが、生体中には水に次いで多く存在し、細胞の約15%を占める生体にとって最も重要な生体高分子の一つです。生命現象の基本である生体分子間の相互作用や生体内反応のほとんどにタンパク質が働いていますので、タンパク質は生命活動の担い手です。さらに薬学にとって重要なことは、ほとんどのくすりがタンパク質に作用して病気の治療に役立っているということです。
タンパク質の立体構造を数10ピコメートル(ピコメートルは1兆分の1メートル)の正確さで決める!
タンパク質は19種類のL-アミノ酸とグリシンがペプチド結合によってつながったポリペプチドで、アミノ酸の配列は遺伝子の塩基配列にしたがって、細胞の中のタンパク質合成工場であるリボゾーム(2009年のノーベル化学賞はこの巨大分子の立体構造をX線結晶構造解析で決めることに成功させた3名の科学者に与えられました)で作られます。その長さは数10残基から数1000残基と多様です。タンパク質の長いポリペプチド鎖は1)そのアミノ酸配列によって自発的に、もしくは2)タンパク質の折り畳みを助ける分子シャペロンとよばれるタンパク質の働きを借りて、もしくは3)相互作用するタンパク質に出合ったときお互いの相互作用を通して、折り畳まれ三次元的に固有の立体構造をとり働きます。私たちはおもにX線結晶構造解析法で重要なタンパク質の立体構造を数10ピコメートルの正確さで決定して、タンパク質が働く仕組みを原子の位置のレベルで調べています。
生物が遺伝子DNA塩基の正常と異常を見分ける仕組みの一つが分る!
遺伝子であるDNAの塩基は地球環境では自然突然変異がひんぱんに起きることが分っています。それはDNA塩基が化学的には不安定で修飾を受けやすいためです。このDNA塩基の修飾のうち生物にとって不都合なものをDNA塩基の損傷と呼びます。そこで生物はいろいろな方法で、DNA塩基の損傷を防ぐ仕組みをもっています。その一つがDNA合成の原料であるdNTP(デオキシヌクレオシド三リン酸の略)の損傷を見つけて、原料にならないように分解する酵素の存在です。
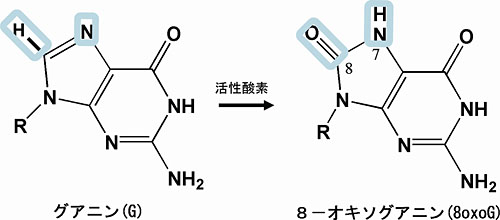
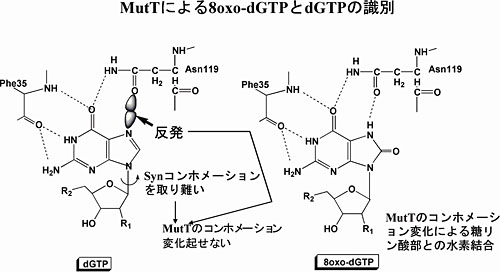
DNA塩基のなかでグアニンは、生物の生命活動によって生じる活性酸素で酸化され8-オキソグアニンになります(左図)が、これは通常のシトシンとの塩基対のみならずアデニンともミス塩基対の形成が可能なため、DNA複製の過程で突然変異をおこしてしまいます。「活性酸素により老化になる」といった広くマスコミなどで流される情報の根拠の一つでもあります。それに対して、多くの生物には8-オキソグアニンをもつdNTP である8-oxo-dGTPを分解する酵素(大腸菌ではMutTと名づけられており、1992年当時九州大学の関口睦夫先生がその機能を発見された)が存在し、8-oxo-dGTP がDNA複製(合成)の原料にならない、すなわち突然変異を起さない仕組みになっています。
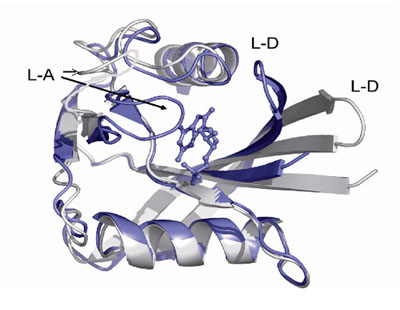
本分野で、大腸菌のMutTの立体構造を基質アナログ(生成物)が結合したときと結合していないものについて結晶をつくり、X線結晶構造解析をしたところ、下左図に示したようにMutTは大きな構造変化を起して基質アナログを捕まえていることが分りました。また、上の図に四角で囲んだようなわずかな化学構造の違い(DNA塩基の正常(左)と異常(右))をどのようにMutTは識別しているかについても下右図に示したように1本の水素結合の増加(これはまさしくAsn119の側鎖のカルボニル酸素の位置が30ピコメートルずれることによりおこります)、基質の安定なSynコンホメーション、MutTの大きな構造変化による基質との多くの相互作用によってMutTは8-oxo-dGTPに対してdGTPと比較して約20000倍という大きな親和性を獲得したことが明らかになりました。
がん治療に役立つくすりの標的になるタンパク質の立体構造にもとづき、くすりをデザインする!
ヒトにも大腸菌MutTと同じ働きをする酵素(hMTH1とよぶ)があり、この酵素についても基質結合型(反応に必要な金属2価イオンがないので反応はおこらない)の立体構造を決定しました。この酵素は、正常な細胞では自然突然変異を防ぎ、がん化を抑えていますが、酸化的環境にあるがん細胞(たとえば脳腫瘍細胞)では、がん細胞の生存に働き、hMTH1がないと細胞死するというデータがあるので、hMTH1の阻害剤は、がんの治療薬の一つなる可能性があります。そこで私たちは解析したhMTH1の立体構造に基づき活性部位(基質結合)に強く結合しhMTH1の働きを阻害する化合物の設計を、コンピュータを用いて(in silicoで)行っています。阻害活性をもつと予想される化合物のみを実験で調べるといいので、経費や手間の節約になります。
(機能分子構造解析学分野)