


固定コンホメーションを持つ化合物によるキラル反応場設計
不斉合成にも、容易に入手できるキラル化合物中の不斉炭素を活かして化学変換していく“キラルプール法”や、反応基質にキラル化合物を“不斉補助剤”として結合させて反応を行い、反応後に不斉補助剤を除去するという“ジアステレオマー法”など、いろいろと種類がありますが、アキラル(achiral)な基質を反応させてキラル(chiral)な化合物を得る“エナンチオマー法”において、反応の触媒としてキラル化合物を使うものは、少ない不斉源で多くのキラル化合物が合成可能であり極めて有用性が高いものであると言えます。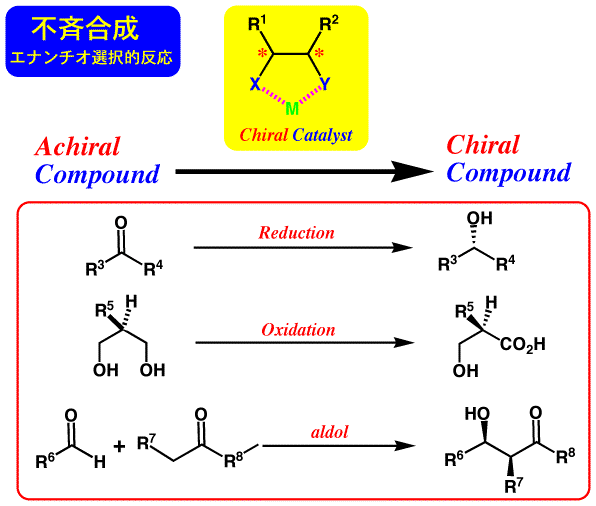
効率良いキラル触媒(Chiral Catalyst)としては、キラル配位子を有する金属触媒が極めて重要であり、特に効率良く不斉空間を構築できる“配位子”の開発は、多くの不斉合成研究者が取り組んでいる課題です。
キラル触媒のまわりで、効率良い空間識別、が行われていれば、反応基質や試薬の触媒への接近方向が規定され反応の選択性が高くなるものと考えられます。配位子についている置換基R1、R2の立体障害が、その空間識別に大きな役割を果たします。
R1、R2が大きな(嵩高い)ものであれば空間識別には有利なのですが、配位子分子のコンホメーションとしてはR1とR2はお互いに離れていたほうが有利ですので、AよりはBのコンホメーションのほうが安定です。金属Mに配位するときにはAのコンホメーションをとることが必要ですから、X…MやY…Mの結合が強くて R1、R2の立体反発を押さえることが出来る事が重要となってきます。
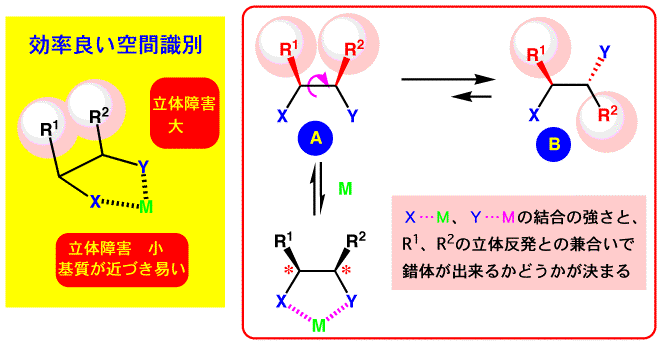
ところで、A-B間のコンホメーション変化は、C-C結合の回転によりおきます。
この“回転”がおきないような化合物を用いれば、大きな立体障害を導入しても容易に金属に配位できるはずです。
これが、我々が“固定コンホメーション化合物”をキラル配位子として利用するための研究をはじめた理由です。
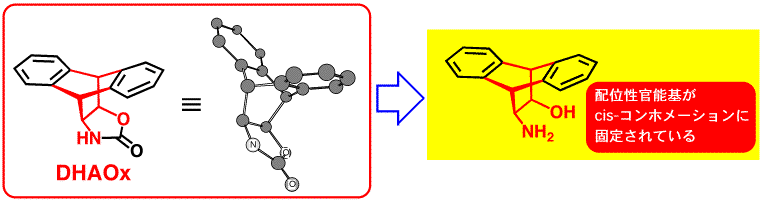
我々は、過去に不斉補助剤の開発研究で、ビシクロ環を有する2-オキサゾリジノン体DHAOxをEvans試薬(不斉補助剤として世界中で使われており、市販もされています)を超えるものとして発表してきましたが、この2-オキサゾリジノン骨格を開環した2-アミノアルコール体は、配位性官能基であるアミノ基と水酸基がcis-配置に固定されたものであり、まさに“固定コンホメーション化合物”として不斉反応場構築に利用可能なものであると言えます。
このような化合物をキラル配位子として用いた反応を試み、すでにいくつかの興味深い知見を得ています。
ジエチル亜鉛によるアルデヒドのエチル化反応における選択性の逆転
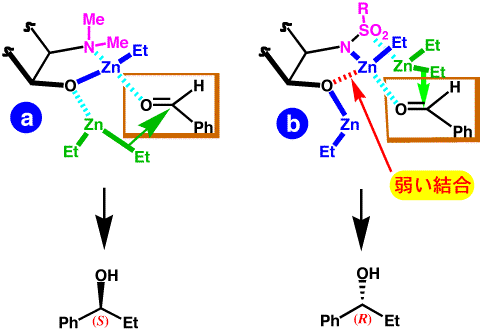
固定コンホメーションを持つアミノアルコールの窒素上の置換基を変えたもの(a,b)を触媒として、ベンズアルデヒドのジエチル亜鉛によるエチル化反応を行った結果を下図に示します。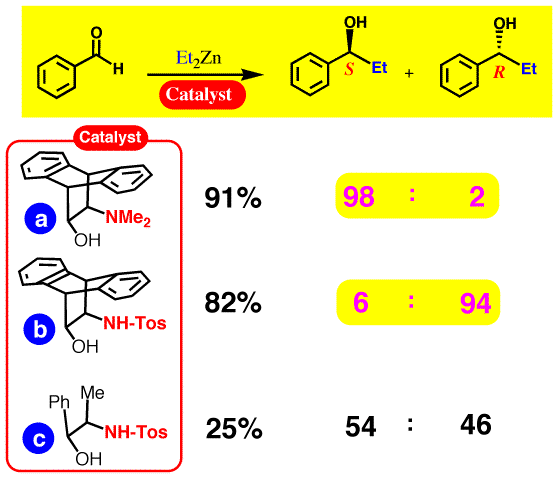
ジメチルアミノ基をもつaだとS体が優先して得られるのに対して、N-トシル体bだとR体が優先して得られます。分子の骨格は全く同じであるのにこのようなエナンチオ選択性の逆転が起こったのは、アミノアルコール体とジエチル亜鉛との結合形式の違いから、エチル化に使われるジエチル亜鉛分子(緑色で表示)の接近方向が逆になるからであると考えらます。
同じ N-トシル体でもcでは収率も選択性も悪いのですが、これは、b における酸素原子と亜鉛原子の間の配位結合(赤点線)が弱い結合であり、コンホメーションの固定されているbにおいては結合を保てるが、c においてはメチル基とフェニル基の立体反発のために配位が保てなくなり触媒として機能しなくなっているものと考えらます。
つまり、この例では固定コンホメーションのために収率・選択性ともに大きく向上したことになります。コンホメーションが固定されているが故に、N上の置換基を変えることで触媒の左右の入替えに成功しているわけです。
触媒cの結果からわかるように、本来だと N-トシル体では触媒としては機能しないのですが、コンホメーション固定によって反応性が惹起されています。一般に、キラル配位子の開発研究においては、アキラルな状態で反応性をもつ官能基についてキラルな骨格を検討するわけですが、これらのことから考えると、反応性ナシと判断された官能基に関してもコンホメーション固定化合物で再検討する価値はあると言えます。
我々は、このような観点から、上記のようなビシクロ環骨格によりコンホメーションが固定された化合物(アミノアルコール、ジアミン、アミノチオール)を用いて、さまざまな反応におけるキラル配位子としての性能評価を行い始めています。すでに、いくつかの興味深い反応性を見出しており、まとめて論文発表出来る日も近いと考えているところであります。