Project 2
ユビキチン-プロテアソームシステムを標的とする
がん治療薬リード化合物の探索研究
Project 2
ユビキチン-プロテアソームシステムを標的とする
がん治療薬リード化合物の探索研究

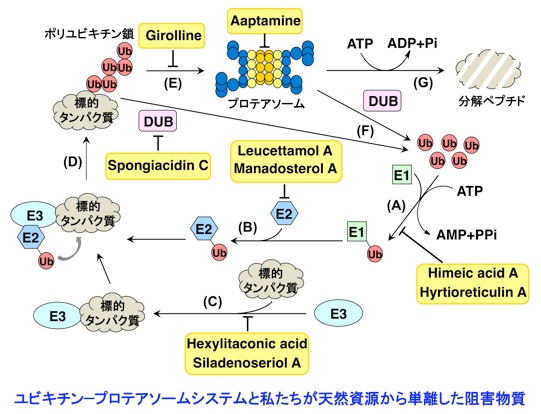
ユビキチン-プロテアソームシステムは、ユビキチン化を触媒するユビキチンシステムと、分解マシンであるプロテアソームから構成されています。そして、生体内において分解される運命にあるタンパク質は、ユビキチンシステムによりポリユビキチン化された後(ステップA〜D)、プロテアソームへとリクルート(ステップE)され、脱ユビキチン化(ステップF)の後にプロテアソームにより選択的に分解されます(ステップG)。ユビキチン-プロテアソームシステムは、細胞周期の進行、シグナル伝達、遺伝子発現制御、タンパク質の品質管理など、多様な生命現象に関与しています。したがって、この分解系の破綻は疾病につながり、また一方では、この分解系が創薬の標的となります。2003年に、プロテアソーム阻害物質である Velcade が多発性骨髄腫の治療薬としてアメリカで認可され、現在では世界77カ国で使用されています。さらに、海洋微生物から発見された salinosporamide A という化合物の臨床試験が2006年から始まっています。2004年にノーベル化学賞がユビキチン研究者に授与されましたが、生命科学の分野においてはユビキチン-プロテアソームシステムの機構に関する研究が活発に行われています。私たちは、ユビキチン-プロテアソームシステムを創薬のためのターゲットとして考え、この分解系を阻害する化合物を天然資源から探索しています。その中でも、がん抑制遺伝子産物である p53 タンパク質の分解を阻害し、その結果、抗がん作用を示すことが期待できるような化合物の探索を重点的に行っています(下記(3)〜(5)の項、参照)。
(1)プロテアソーム阻害物質 (ステップG)
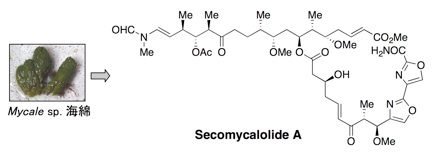
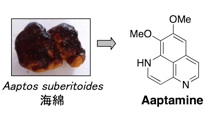
プロテアソームは細胞内に普遍的に存在するタンパク質分解酵素で、がん細胞で活性が高いことが知られています。プロテアソームの生理機能解明のツールとして、また、抗がん剤の候補として、現在までに、いろいろな阻害機構に基づくプロテアソーム阻害剤が合成され、あるいは天然資源から単離されています。私たちは、プロテアソーム阻害剤のスクリーニングを行い、海綿や生薬のチモから新規プロテアソーム阻害物質を単離しています。現在、より活性の強い化合物の発見を目指して研究中です。
1.Salsolinol: Chem. Pharm. Bull. 59 (2), 287-290 (2011).
2.Aaptamine: Bioorg. Med. Chem. Lett. 20 (11), 3341-3343 (2010).
3.Lignans from Anemarrhenae Rizoma: Biol. Pharm. Bull. 28 (9), 1798-1800 (2005).
4.Secomycalolide A: Mar. Drugs 3 (2), 29-35 (2005).
(2)ユビキチン活性化酵素(E1)阻害物質 (ステップA)
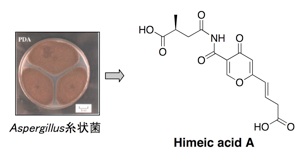
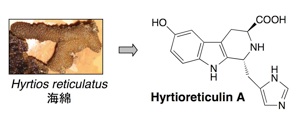
ユビキチン活性化はユビキチンシステムの1番初めの段階ですが、その機構には、まだ未解明の部分が多く残されています。したがって、この段階を特異的に阻害する化合物は、ユビキチン活性化の機構の詳細を研究するための分子ツールになると考えられます。また、E1, E2, E3酵素から構成されるユビキチンシステムのいずれかを阻害した場合にもプロテアソームによるタンパク質分解は阻害されますので、プロテアソームを阻害した場合と同様に抗がん剤を発見できると期待されます。私たちは、E1阻害物質を探索するためのアッセイ系を確立し新規阻害物質 himeic acid A を発見しました。E1を阻害する化合物としては、2 例目に発見された化合物です。さらに最近、新たに hyrtioreticulin A を海綿から単離しました。E1 阻害作用はハイスループットスクリーニングではテストできないため、これまでに合成化合物も含めて 6 種類の E1 阻害物質しか報告されていません。これら化合物の中でも hyrtioreticulin A は最も強い E1 阻害作用を示すことがわかりました。
1. Himeic acid A: Bioorg. Med. Chem. Lett. 15 (1), 191-194 (2005).
2. Hyrtioreticulin A: Bioorg. Med. Chem. 20 (14), 4437-4442 (2012).
(3)ユビキチン結合酵素(E2)阻害物質 (ステップB)
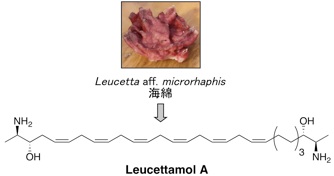
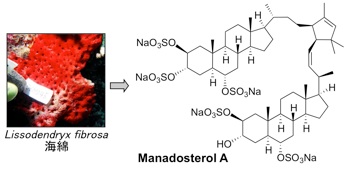
E2 は複数存在しますが、その中でも、Ubc13 は Uev1A とヘテロ複合体を形成してE2酵素として働きます。そして、生合成中の p53 に Ubc13-Uev1A 複合体が結合すると、p53 の K63-ユビキチン化が起こり発がんに至ることが報告されています。したがって、Ubc13-Uev1A 複合体形成を阻害する化合物は、がん抑制作用を示すと考えられます。私たちは、Ubc13-Uev1A 複合体の形成を検出するアッセイ系を確立し、世界初のE2阻害物質として海綿からleucettamol A を単離することに成功しました。その後、より阻害作用の強い manadosterol A を海綿から単離しました。
1.Leucettamol A: Bioorg. Med. Chem. Lett. 18 (24), 6319-6320 (2008).
2.Manadosterol A: J. Nat. Prod. 75 (8), 1495-1499 (2012).
(4)ユビキチンリガーゼ(E3)阻害物質 (ステップC)
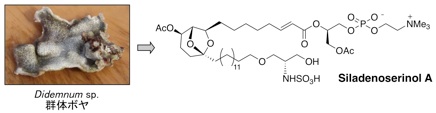
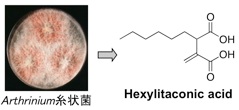
プロテアソームによって選択的にタンパク質が分解される際、生体内に存在する多くのタンパク質の中から分解すべきタンパク質を認識するのは E3 です。1997年に、p53 の E3 は Hdm2(ヒト Mdm2)であることが明らかにされました。このことから、Hdm2 拮抗剤は、p53 に対する負の調節因子である Hdm2 の作用を阻害するだけでなく、p53 の分解を阻害することにより、生体内における p53 レベルを上昇させると考えられます。したがって、Hdm2 拮抗剤は、p53 のがん抑制タンパク質としての機能である「細胞修復」や「アポトーシス」を亢進させる新しいタイプのがん治療薬として期待できます。合成化合物のライブラリーから発見された Nutlin は、in vivo においてもがん縮小効果を示したことから、前臨床試験が行われていますが、天然資源からの探索研究はほとんど行われていないのが現状です。私たちは、p53-Hdm2 複合体の形成を検出するアッセイ系を確立してスクリーニングを行いました。そして、海綿由来の糸状菌や群体ボヤから阻害物質を発見することに成功しました。
1.Hexylitaconic acid: Bioorg. Med. Chem. Lett. 16 (1), 69-71 (2006).
2.Siladenoserinol A: Org. Lett. 15 (2), 322-325 (2013).

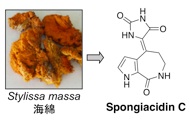
(5)USP7阻害物質 (ステップF)
Hdm2 は自らをポリユビキチン化してプロテアソームにより分解されます。この時、脱ユビキチン化酵素 USP7 は Hdm2 に結合して自己ユビキチン化された Hdm2 からユビキチンを除去する働きをしているので、結果として p53の分解が起きます。したがって、USP7 に対する阻害物質は Hdm2 の分解を誘導することにより p53 を安定化させるので、選択性の高いがん治療薬になると考えられます。私たちはスクリーニングを行い、海綿から spongiacidin Cを単離しました。
1. Spongiacidin C: Bioorg. Med. Chem. Lett. 23 (13), 3884-3886 (2013).
ユビキチン-プロテアソームシステム関係の総説
1.塚本佐知子、横沢英良. ユビキチン修飾系を標的とする創薬シーズの探索. 実験医学増刊「シグナル伝達 研究最前線2012」、編集:井上純一郎、武川睦寛、徳永文稔、今井浩三、羊土社、30 (5), 171-176 (2012).
2.塚本佐知子、横沢英良. ユビキチン依存的タンパク質分解系を標的とする創薬. 化学と生物、 49 (11), 745-754 (2011).
3.塚本佐知子、横沢英良.タンパク質分解の不思議:ユビキチン‐プロテアソームシステムの仕組みと創薬.愛知学院大学薬学会誌 3, 1-18 (2010).
4.Tsukamoto Tsukamoto, S., Yokosawa, H. Inhibition of the Ubiquitin-proteasome System by Natural Products for Cancer Therapy. Planta Med. 76 (11), 1064-1074 (2010).
5.Tsukamoto, S., Yokosawa, H. Targeting the proteasome-mediated proteolytic pathway, Expert Opin. Ther. Targets 13 (5), 605-621 (2009).
6.塚本佐知子. ユビキチンリガーゼを分子標的とする新規抗がん剤の海洋生物からの探索. 薬学研究の進歩研究成果報告集、24, 45-51 (2008).
7.塚本佐知子、横沢英良. 展開するプロテアソーム阻害剤研究. 実験医学増刊「細胞内の輪廻転生 タンパク質の分解機構」、編集:田中啓二、羊土社、26, 122-127 (2008).
8.Tsukamoto, S. The Search for Inhibitors of the Ubiquitin-proteasome System from Natural Resources for Drug Development. J. Nat. Med. 60 (4), 273-278 (2006).
9.Tsukamoto, S., Yokosawa, H. Natural Products Inhibiting the Ubiquitin-proteasome Proteolytic Pathway, a Target for Drug Development. Curr. Med. Chem. 13 (7), 745-754 (2006).
10.塚本佐知子、横沢英良. ユビキチン-プロテアソームシステムをターゲットとする天然物化学・創薬化学の新しい展開. 有機合成化学協会誌、62, 968-976 (2004).