MEK/ERK signaling cascadeが制御するHIV脱殻機構
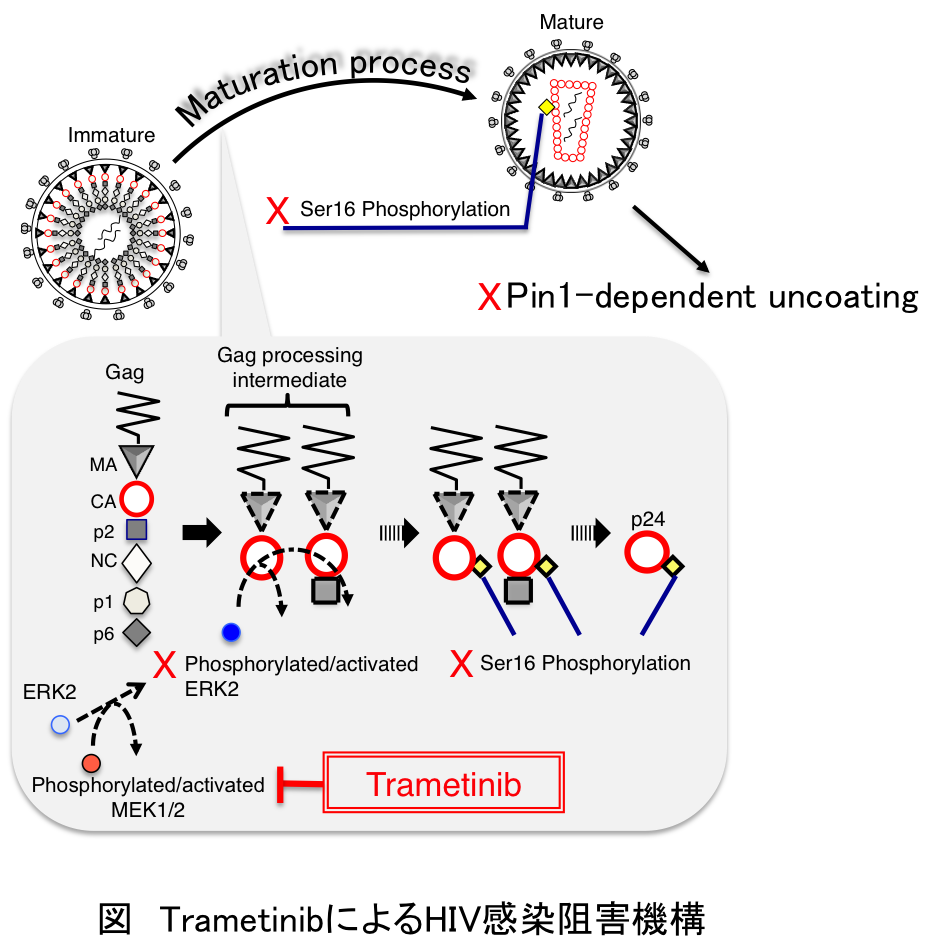
本研究では、MEK阻害剤として世界で初めて承認されたTrametinibがHIV脱殻過程を阻害することにより、HIV複製を阻害することを明らかにした(Biochem. Biophys. Res. Commun. (2018) 495(2): 1846-1850)。堂地・三隅等は、HIV粒子プロテオーム解析の結果、HIVがコードするCAタンパク質のSer16-Pro17モチーフにおいてSer残基特異的にリン酸化を受けていることを明らかにしてきた(J. Biol. Chem. (2010) 285, 25185-25195)。そして、このリン酸化を受けたモチーフを細胞内ペプチジルプロリルイソメラーゼPin1が認識することにより、HIV-1 RNAを保護していたCAコアのSer16-Pro17モチーフにおけるcis-trans異性化反応を介して崩壊するというHIV脱殻過程の新たなモデルを提唱している。さらに、CAタンパク質のSer16-Pro17モチーフをSer残基特異的にリン酸化する酵素がERK2であることを同定した。(J. Gen. Virol. (2014) 95, 1156-1166)。ウイルス出芽時、ERK2はCAタンパク質の前駆体であるPr55とともにウイルス粒子内に取り込まれる。その後、前駆体タンパク質Pr55はHIV Proteaseによってprocessingをうけ、intermediatesを生じると、CAタンパク質のSer16-Pro17モチーフがERK2によってリン酸化を受けるというモデルを見出した。本研究では、HIV持続感染細胞をTrametinib処理することにより得られたウイルスは、ウイルス粒子内に取り込まれているMEK1/2の活性が阻害されることにより、ウイルス粒子内のERK2の活性化が阻害され、結果的にSer16のリン酸化の効率が低下し、Pin1依存的な脱殻過程が効率的に進行しないために、感染価が低下することを明らかにした。本知見を基にして、脱殻過程そのものを阻害する新規治療戦略を立案したいと考えている。